règles pour déterminer les priorités
ces règles sont connues sous le nom de règles Cahn-Ingold-Prelog (CIP) d’après les personnes qui ont développé le système.
La première règle pour les cas très simples
Vous regardez d’abord les atomes attachés directement aux atomes de carbone à chaque extrémité de la double liaison – de réfléchir sur les deux extrémités séparément.
-
L’atome qui a le plus de numéro atomique est donné la priorité la plus élevée.
prenons l’exemple dont nous avons parlé.,

il suffit de considérer le premier isomère – et d’examiner séparément la gauche puis la droite atome de carbone. Comparez les numéros atomiques des atomes attachés pour déterminer les différentes priorités.
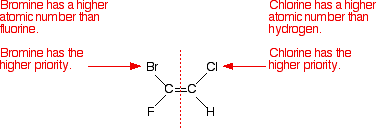
Notez que les atomes les plus prioritaires sont tous les deux du même côté de la double liaison. Ce qui compte comme le (Z)- isomère.
le deuxième isomère a évidemment toujours les mêmes atomes à chaque extrémité, mais cette fois les atomes de priorité supérieure sont sur les côtés opposés de la double liaison. C’est le (E)- isomère.,
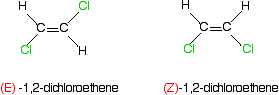
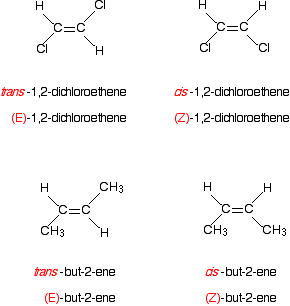
Qu’en est-il des exemples plus familiers comme le 1,2-dichloroéthène ou le but-2-en? Voici le 1,2-dichloroéthène.

Pense à propos de la priorité des deux groupes sur le premier carbone de la gauche isomère.
Le chlore a un numéro atomique plus élevé que l’hydrogène et a donc la priorité la plus élevée. Qui, bien sûr, est également vrai de tous les autres atomes de carbone dans ces deux isomères.
dans le premier isomère, les groupes prioritaires les plus élevés sont sur les côtés opposés de la liaison. Que doit être le (E)- isomère., L’autre, avec les groupes prioritaires du même côté, est l’isomère (Z).
Et maintenant, but-2-ène . . .
Cela s’ajoute la légère complication que vous n’avez pas un seul atome attaché à la double liaison, mais un groupe d’atomes.
ce n’est pas un problème. Se concentrer sur l’atome directement attaché à la double liaison – dans ce cas, le carbone dans le groupe CH3. Pour ce cas simple, vous pouvez ignorer complètement les atomes d’hydrogène du groupe CH3., Cependant, avec des groupes plus compliqués, vous devrez peut-être vous soucier des atomes qui ne sont pas directement attachés à la double liaison. Nous examinerons ce problème dans un instant.
Voici l’un des isomères de but-2 -e:

le groupe CH3 a la priorité la plus élevée car son atome de carbone a un numéro atomique de 6 comparé à un numéro atomique de 1 pour l’hydrogène également attaché à la double liaison carbone-carbone.
L’isomère dessiné ci-dessus a les deux groupes de priorité plus élevés sur les côtés opposés de la double liaison. Le composé est (E)-but-2 -e.,
Un petit ajout à la règle pour permettre isotopes de l’, par exemple, de l’hydrogène
le Deutérium est un isotope de l’hydrogène ayant une masse atomique relative de 2. Il n’a toujours que 1 proton, et a donc toujours un numéro atomique de 1. Cependant, ce n’est pas la même chose qu’un atome d’hydrogène « ordinaire », et donc ces deux composés sont des isomères géométriques:

l’hydrogène et le deutérium ont le même numéro atomique – donc sur cette base, ils auraient la même priorité., Dans un tel cas, celui avec la plus grande masse atomique relatives a la priorité la plus élevée. Donc, dans ces isomères, le deutérium et le chlore sont les groupes prioritaires à chaque extrémité de la double liaison.
cela signifie que l’isomère de gauche dans le dernier diagramme est la forme (E) -, et celui de droite le (Z) -.
étendre les règles aux molécules plus compliquées
Si vous lisez ceci parce que vous faites un cours pour les 16-18 ans comme UK a level, vous n’avez peut – être pas besoin de savoir grand-chose sur cette section, mais ce n’est vraiment pas très difficile!,
illustrons cela en prenant une molécule assez effrayante, et en voyant à quel point il est facile de savoir s’il s’agit d’un isomère (Z) ou (E) en appliquant une règle supplémentaire.
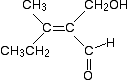
concentrez-vous sur l’extrémité gauche de la molécule. Qu’est-ce qui est attaché directement à la double liaison carbone-carbone?
dans les deux groupes attachés, un atome de carbone est attaché directement à la liaison. Ces deux atomes ont évidemment le même numéro atomique et donc la même priorité. Donc ça n’aide pas.,
dans ce genre de cas, vous regardez maintenant ce qui est attaché directement à ces deux carbones (mais sans compter le carbone de la double liaison) et comparez les priorités de ces prochains lots d’atomes.
Vous pouvez le faire dans votre tête dans des cas simples, mais il est parfois utile d’écrire les atomes attachés, en les énumérant avec l’atome de priorité la plus élevée en premier. Cela les rend plus faciles à comparer. Pareil . . .
Dans le groupe CH3:
Les atomes de carbone sont H H H.
Dans le CH3CH2 groupe:
Les atomes attachés directement à la teneur en carbone du groupe CH2 C H H.,
dans la deuxième liste, le C est écrit en premier parce qu’il a le numéro atomique le plus élevé.
Comparez maintenant les deux listes atome par atome. Le premier atome de chaque liste est un H dans le groupe CH3 et un C dans le groupe CH3CH2. Le carbone a la priorité la plus élevée car il a le numéro atomique le plus élevé. Cela donne donc au groupe CH3CH2 une priorité plus élevée que le groupe CH3.
Maintenant, regardez l’autre extrémité de la double liaison. La chose supplémentaire que cela illustre est que si vous avez une double liaison, vous comptez l’atome attaché deux fois. Voici à nouveau la structure.,

donc, encore une fois, les atomes attachés directement à la double liaison carbone-carbone sont les deux carbones. Nous devons donc examiner ce qui est attaché à ces carbones.
Dans le groupe CH2OH:
Les atomes directement attaché au carbone sont O H H.
Dans le CHO groupe:
Les atomes directement attaché au carbone sont O O H. Rappelez-vous que l’oxygène est compté deux fois en raison de la liaison double carbone-oxygène.
dans les deux listes, les oxygènes sont écrits en premier parce qu’ils ont un numéro atomique plus élevé que l’hydrogène.,
Alors, quelle est la priorité des deux groupes? Le premier atome dans les deux listes est un oxygène-cela n’aide pas. Regardez l’atome suivant dans les deux listes. Dans le groupe CH2OH, c’est un hydrogène; dans la liste CHO, c’est un oxygène.
l’oxygène a la priorité la plus élevée – et cela donne au groupe CHO une priorité plus élevée que le groupe CH2OH.
l’isomère est donc une forme (Z), car les deux groupes de priorité supérieure (le groupe CH3CH2 et le groupe CHO) sont tous deux du même côté de la liaison.
cela a été une explication assez longue juste pour expliquer clairement comment cela fonctionne., Avec un peu de pratique, il ne prend que quelques secondes pour travailler dans les cas les plus complexes.
Un autre exemple pour faire quelques points mineurs supplémentaires . . .
Voici une molécule encore plus compliquée!
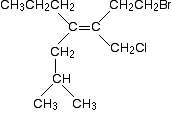
avant de continuer, essayez de déterminer les priorités relatives des deux groupes à l’extrémité gauche de la double liaison et des deux à l’extrémité droite., Il y a une autre règle que je ne vous ai pas encore spécifiquement dite, mais il n’est pas difficile de deviner ce que cela pourrait être lorsque vous commencez à regarder le problème. Si vous pouvez résoudre ce problème, alors vous n’aurez aucune difficulté avec un problème que vous êtes susceptible de rencontrer à ce niveau.
regardez d’abord les groupes de gauche.
dans les groupes supérieur et inférieur, vous avez un groupe CH2 attaché directement à la double liaison carbone-carbone, et le carbone de ce groupe CH2 est également attaché à un autre atome de carbone. Dans chaque cas, la liste se lira C H H.,
Il n’y a pas de différence entre les priorités de ces groupes, alors qu’allez-vous faire à ce sujet? La réponse est de passer le long de la chaîne au groupe suivant. Et si nécessaire, continuez à le faire jusqu’à ce que vous ayez trouvé une différence.
suivant le long de la chaîne en haut à gauche de la molécule est un autre groupe CH2 attaché à un autre atome de carbone. La liste de ce groupe est à nouveau C H H.
mais le groupe suivant le long de la chaîne en bas à gauche est un groupe CH attaché à deux autres atomes de carbone. Sa liste est donc C C H.,
la comparaison de ces listes atome par atome, vous amène au fait que le groupe inférieur a la priorité la plus élevée.
regardez maintenant les groupes de droite. Voici à nouveau la molécule:

Le groupe supérieur droit A C H H attaché au premier carbone de la chaîne.
celui en bas à droite a Cl H H.
le chlore a un numéro atomique plus élevé que le carbone, et donc le groupe en bas à droite a la priorité la plus élevée de ces deux groupes.,
Le point supplémentaire, je suis en train de faire avec ce morceau de l’exemple est que vous devez vous concentrer sur un peu d’une chaîne à la fois. Nous n’arrivons jamais à considérer le brome à l’extrême en haut à droite de la molécule. Nous n’avons pas besoin d’aller aussi loin le long de la chaîne – vous travaillez un maillon à la fois jusqu’à ce que vous trouviez une différence. Tout ce qui dépasse cela n’est pas pertinent.
Pour mémoire, cette molécule est un (Z)- isomère car les groupes prioritaires à chaque extrémité sont du même côté de la double liaison.,
Pouvez-vous traduire facilement cis – et trans – en (Z) et (E)?
vous pourriez penser que pour les cas simples, cis – se convertira simplement en (Z)- et trans – en (E)-.
regardez par exemple les cas du 1,2-dichloroéthène et du but-2-en.
Mais ça ne fonctionne pas toujours! Pensez à cette molécule relativement simple . . .
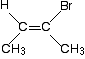
C’est clairement un cis – isomère. Il a deux groupes CH3 du même côté de la double liaison. Mais déterminez les priorités à l’extrémité droite de la double liaison.,
Les deux atomes directement attachés sont le carbone et le brome. Le brome a le numéro atomique le plus élevé et a donc la priorité la plus élevée à cette fin. À l’autre extrémité, le groupe CH3 a la priorité la plus élevée.
cela signifie que les deux groupes de priorité supérieure sont sur les côtés opposés de la double liaison, et c’est donc un (E)- isomère – pas un (Z)-.
ne supposez jamais que vous pouvez convertir directement de l’un de ces systèmes dans l’autre. La seule chose sûre à faire est de recommencer à zéro dans chaque cas.
est-il important que les deux systèmes donnent parfois des résultats différents? Non!, Le but des deux systèmes est de vous permettre de décoder un nom et d’écrire une formule correcte. Correctement utilisés, les deux systèmes le feront pour vous-bien que le système cis-trans ne fonctionne que pour des molécules très simples.
les Questions pour tester votre compréhension
Si c’est la première série de questions que vous avez fait, merci de lire la page d’introduction avant de commencer. Vous devrez utiliser le bouton Retour de votre navigateur pour revenir ici par la suite.,
les questions sur l’E/Z notation
réponses
Où aimeriez-vous aller maintenant?
Au menu isomérisme. . .
au menu de la chimie organique de base. . .
Au Menu Principal . . .