Regeln für die Bestimmung von Prioritäten
Diese werden als Cahn-Ingold-Prelog (CIP) – Regeln nach den Personen bezeichnet, die das System entwickelt haben.
Die erste Regel für sehr einfache Fälle
Sie betrachten zuerst die Atome, die direkt an den Kohlenstoffatomen an jedem Ende der Doppelbindung befestigt sind – und denken getrennt über die beiden Enden nach.
-
Das Atom mit der höheren Ordnungszahl erhält die höhere Priorität.
Schauen wir uns das Beispiel an, über das wir gesprochen haben.,

Betrachten Sie einfach das erste Isomer – und betrachten Sie getrennt das linke und dann das rechte Kohlenstoffatom. Vergleichen Sie die Ordnungszahlen der angehängten Atome, um die verschiedenen Prioritäten zu ermitteln.
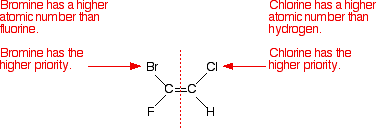
Beachten Sie, dass sich die Atome mit den höheren Prioritäten beide auf derselben Seite der Doppelbindung befinden. Das zählt als (Z) – Isomer.
Das zweite Isomer hat offensichtlich immer noch die gleichen Atome an jedem Ende, aber diesmal befinden sich die Atome mit höherer Priorität auf gegenüberliegenden Seiten der Doppelbindung. Das ist das (E) – Isomer.,
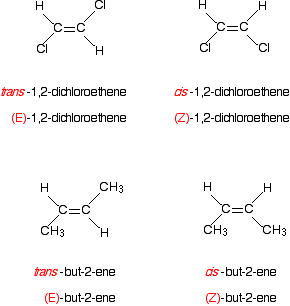
Was ist mit den bekannteren Beispielen wie 1,2-Dichlorethen oder but-2-en? Hier ist 1,2-Dichlorethen.

Denken Sie an die Priorität der beiden Gruppen auf dem ersten Kohlenstoff des linken Isomers.
Chlor hat eine höhere Ordnungszahl als Wasserstoff, und so hat die höhere Priorität. Das gilt natürlich auch für alle anderen Kohlenstoffatome in diesen beiden Isomeren.
Im ersten Isomer befinden sich die Gruppen mit höherer Priorität auf gegenüberliegenden Seiten der Bindung. Das muss das (E)- isomer., Die andere, mit den höheren Prioritätsgruppen auf der gleichen Seite, ist das (Z) – Isomer.
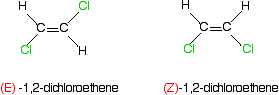
Und nun but-2-ene . . .
Dies fügt die leichte Komplikation hinzu, dass Sie kein einzelnes Atom an die Doppelbindung gebunden haben, sondern eine Gruppe von Atomen.
Das ist kein Problem. Konzentrieren Sie sich auf das Atom, das direkt an die Doppelbindung gebunden ist-in diesem Fall auf den Kohlenstoff in der CH3-Gruppe. In diesem einfachen Fall können Sie die Wasserstoffatome in der CH3-Gruppe vollständig ignorieren., Bei komplizierteren Gruppen müssen Sie sich jedoch möglicherweise Gedanken über Atome machen, die nicht direkt an die Doppelbindung gebunden sind. Wir werden uns das Problem gleich ansehen.
Hier ist eines der Isomere von but-2-ene:

Die CH3-Gruppe hat die höhere Priorität, da ihr Kohlenstoffatom eine Ordnungszahl von 6 hat, verglichen mit einer Ordnungszahl von 1 für den Wasserstoff, der ebenfalls an die Kohlenstoff-Kohlenstoff-Doppelbindung gebunden ist.
Das oben gezeichnete Isomer weist die beiden höheren Prioritätsgruppen auf gegenüberliegenden Seiten der Doppelbindung auf. Die Verbindung ist (E)-but-2-en.,
Eine geringfügige Ergänzung der Regel, um Isotope von beispielsweise Wasserstoff zu ermöglichen
Deuterium ist ein Isotop von Wasserstoff mit einer relativen Atommasse von 2. Es hat immer noch nur 1 Proton und hat daher immer noch eine Ordnungszahl von 1. Es ist jedoch nicht dasselbe wie ein Atom aus „gewöhnlichem“ Wasserstoff, und daher handelt es sich bei diesen beiden Verbindungen um geometrische Isomere:

Wasserstoff und Deuterium haben dieselbe Ordnungszahl – auf dieser Grundlage hätten sie dieselbe Priorität., In einem solchen Fall hat derjenige mit der höheren relativen Atommasse die höhere Priorität. In diesen Isomeren sind Deuterium und Chlor die Gruppen mit höherer Priorität an jedem Ende der Doppelbindung.
Das bedeutet, dass das linke Isomer im letzten Diagramm die (E)- Form und das rechte die (Z)-Form ist.
Erweiterung der Regeln auf kompliziertere Moleküle
Wenn Sie dies lesen, weil Sie einen Kurs für 16 – 18-Jährige wie UK machen Ein Niveau, Sie müssen vielleicht nicht viel über diesen Abschnitt wissen, aber es ist wirklich nicht sehr schwierig!,
Lassen Sie uns dies veranschaulichen, indem wir ein ziemlich beängstigend aussehendes Molekül nehmen und sehen, wie einfach es ist, herauszufinden, ob es ein (Z)-oder (E) – Isomer ist, indem wir eine zusätzliche Regel anwenden.
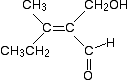
Fokus auf das linke Ende des Moleküls. Was ist direkt an der Kohlenstoff-Kohlenstoff-Doppelbindung befestigt?
In beiden beigefügten Gruppen ist ein Kohlenstoffatom direkt an die Bindung gebunden. Diese beiden Atome haben offensichtlich die gleiche Ordnungszahl und daher die gleiche Priorität. Das hilft also nicht.,
In dieser Art von Fall schauen Sie sich nun an, was direkt an diesen beiden Kohlenstoff gebunden ist (aber ohne den Kohlenstoff der Doppelbindung zu zählen) und vergleichen die Prioritäten dieser nächsten Menge von Atomen.
Sie können dies in einfachen Fällen in Ihrem Kopf tun, aber es ist manchmal nützlich, die angehängten Atome aufzuschreiben und sie zuerst mit dem Atom mit der höchsten Priorität aufzulisten. Es macht Sie einfacher zu vergleichen. Wie das hier . . .
In der CH3-Gruppe:
Die an den Kohlenstoff gebundenen Atome sind Hhh
In der CH3CH2-Gruppe:
Die direkt an den Kohlenstoff der CH2-Gruppe gebundenen Atome sind C H H.,
In der zweiten Liste wird das C zuerst geschrieben, weil es die höchste Ordnungszahl hat.
vergleichen Sie Nun die beiden Listen, atom für atom. Das erste Atom in jeder Liste ist ein H in der CH3-Gruppe und ein C in der CH3CH2-Gruppe. Der Kohlenstoff hat die höhere Priorität, weil er die höhere Ordnungszahl hat. Das gibt der CH3CH2-Gruppe also eine höhere Priorität als der CH3-Gruppe.
Schauen Sie nun auf das andere Ende der Doppelbindung. Das Zusätzliche, was dies veranschaulicht, ist, dass Sie das angehängte Atom zweimal zählen, wenn Sie eine Doppelbindung haben. Hier ist die Struktur wieder.,

Die Atome, die direkt an die Kohlenstoff-Kohlenstoff-Doppelbindung gebunden sind, sind also beide Kohlenstoff. Wir müssen daher schauen, was mit diesen Kohlenstoffen verbunden ist.
In der CH2OH-Gruppe:
Die direkt an den Kohlenstoff gebundenen Atome sind O H H.
In der CHO-Gruppe:
Die direkt an den Kohlenstoff gebundenen Atome sind O O H. Denken Sie daran, dass der Sauerstoff aufgrund der Kohlenstoff-Sauerstoff-Doppelbindung zweimal gezählt wird.
In beiden Listen werden die Oxygene zuerst geschrieben, weil sie eine höhere Ordnungszahl als Wasserstoff haben.,
Also, was ist die Priorität der beiden Gruppen? Das erste Atom in beiden Listen ist ein Sauerstoff – das hilft nicht. Schauen Sie sich das nächste Atom in beiden Listen an. In der CH2OH-Gruppe ist das ein Wasserstoff; In der CHO-Liste ist es ein Sauerstoff.
Der Sauerstoff hat die höhere Priorität – und das gibt der CHO-Gruppe eine höhere Priorität als der CH2OH-Gruppe.
Das Isomer ist daher eine (Z) – Form, da sich die beiden Gruppen mit höherer Priorität (die CH3CH2-Gruppe und die CHO-Gruppe) beide auf derselben Seite der Bindung befinden.
Das war eine ziemlich langatmige Erklärung, nur um klar zu machen, wie es funktioniert., Mit ein wenig Übung dauert es ein paar Sekunden, um in den komplexesten Fällen zu trainieren.
Ein weiteres Beispiel, um ein paar zusätzliche kleinere Punkte zu machen . . .
Hier ist ein noch komplizierteres Molekül!
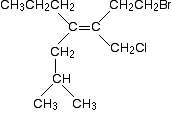
Bevor Sie weiterlesen, sollten Sie die relativen Prioritäten der beiden Gruppen am linken Ende der Doppelbindung und der beiden am rechten Ende ermitteln., Es gibt noch eine Regel, die ich Ihnen noch nicht speziell gesagt habe, aber es ist nicht schwer zu erraten, was es sein könnte, wenn Sie anfangen, das Problem zu betrachten. Wenn Sie dies herausfinden können, haben Sie keine Schwierigkeiten mit Problemen, auf die Sie wahrscheinlich auf dieser Ebene stoßen werden.
Schauen Sie sich zuerst die linken Gruppen an.
Sowohl in der oberen als auch in der unteren Gruppe ist eine CH2-Gruppe direkt an die Kohlenstoff-Kohlenstoff-Doppelbindung gebunden, und der Kohlenstoff in dieser CH2-Gruppe ist auch an ein anderes Kohlenstoffatom gebunden. In jedem Fall liest die Liste C H H.,
Es gibt keinen Unterschied zwischen den Prioritäten dieser Gruppen, also, was werden Sie dagegen tun? Die Antwort ist, sich entlang der Kette zur nächsten Gruppe zu bewegen. Und wenn nötig, machen Sie das weiter, bis Sie einen Unterschied gefunden haben.
Als nächstes entlang der Kette oben links im Molekül ist eine weitere CH2-Gruppe an ein weiteres Kohlenstoffatom gebunden. Die Liste für diese Gruppe ist wieder C H H
Aber die nächste Gruppe entlang der Kette unten links ist eine CH-Gruppe, die an zwei weitere Kohlenstoffatome gebunden ist. Seine Liste ist daher C C H.,
Der Vergleich dieser Listen Atom für Atom führt dazu, dass die untere Gruppe die höhere Priorität hat.
Schauen Sie sich nun die rechten Gruppen an. Hier ist wieder das Molekül:

In der oberen rechten Gruppe ist C H H an den ersten Kohlenstoff in der Kette angehängt.
Die untere rechte hat Cl H H.
Das Chlor hat eine höhere Ordnungszahl als Kohlenstoff, und so hat die untere rechte Gruppe die höhere Priorität dieser beiden Gruppen.,
Der zusätzliche Punkt, den ich mit diesem Teil des Beispiels machen möchte, ist, dass Sie sich jeweils nur auf ein Teil einer Kette konzentrieren müssen. Wir kommen nie dazu, das Brom ganz oben rechts im Molekül zu betrachten. Wir müssen nicht so weit entlang der Kette gehen – Sie arbeiten ein Glied nach dem anderen aus, bis Sie einen Unterschied finden. Alles darüber hinaus ist irrelevant.
Für den Datensatz ist dieses Molekül ein (Z) – Isomer, da sich die Gruppen mit höherer Priorität an jedem Ende auf derselben Seite der Doppelbindung befinden.,
Können Sie cis – und trans – leicht in (Z)- und (E)-übersetzen?
Sie könnten denken, dass cis – für einfache Fälle einfach in (Z)- und trans – in (E)-konvertiert wird.
Schauen Sie sich zum Beispiel die 1,2-Dichlorethen-und but-2-en-Fälle an.
Aber es funktioniert nicht immer! Denken Sie an dieses relativ unkomplizierte Molekül . . .
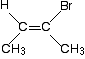
Dies ist eindeutig ein cis – isomer. Es hat zwei CH3-Gruppen auf der gleichen Seite der Doppelbindung. Aber erarbeiten Sie die Prioritäten am rechten Ende der Doppelbindung.,
Die beiden direkt angeschlossenen Atome sind Kohlenstoff und Brom. Brom hat die höhere Ordnungszahl und hat daher die höhere Priorität an diesem Ende. Am anderen Ende hat die CH3-Gruppe die höhere Priorität.
Das bedeutet, dass sich die beiden Gruppen mit höherer Priorität auf gegenüberliegenden Seiten der Doppelbindung befinden, und dies ist ein (E)- Isomer – NICHT ein (Z)-.
Gehen Sie niemals davon aus, dass Sie direkt von einem dieser Systeme in das andere konvertieren können. Die einzige sichere Sache ist, in jedem Fall von vorne zu beginnen.
Spielt es eine Rolle, dass die beiden Systeme manchmal unterschiedliche Ergebnisse liefern? Nein!, Der Zweck beider Systeme besteht darin, Ihnen zu ermöglichen, einen Namen zu dekodieren und eine korrekte Formel zu schreiben. Bei richtiger Verwendung tun dies beide Systeme für Sie – obwohl das cis-trans-System nur für sehr einfache Moleküle funktioniert.
Fragen Ihr Verständnis zu testen
Wenn dies der erste Satz von Fragen, die Sie getan haben, lesen Sie bitte die Einführungsseite, bevor Sie beginnen. Sie müssen die SCHALTFLÄCHE ZURÜCK in Ihrem Browser verwenden, um danach hierher zurückzukehren.,
Fragen zur E/Z-notation
Antworten
Wo möchten Sie jetzt gehen?
Zum Menü Isomerie. . .
Zum Menü der organischen Grundchemie. . .
Zum Hauptmenü . . .