La structure de Lewis de la molécule d’eau contient deux liaisons simples autour de l’atome d’oxygène. nombre d’électrons de valence totale des atomes d’oxygène et d’hydrogène sont utilisés pour dessiner la structure de lewis. Chaque étape du dessin de la structure de lewis de H2O est expliquée dans ce tutoriel.
H2O structure de lewis
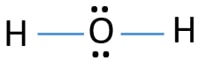
Dans la structure de lewis de H2O, il y a deux liaisons simples autour de l’atome d’oxygène. Les atomes d’hydrogène sont joints à l’atome d’oxygène par des liaisons simples. En outre, il y a deux paires solitaires sur l’atome d’oxygène.,
la molécule D’eau est une molécule simple. Le dessin de la structure de lewis de la molécule d’eau est simple que certains des autres molécules ou ions complexes. Imaginez dessiner la structure de lewis de l’ion thiosulfate.
étapes du dessin de la structure de lewis de H2O
Il y a quelques étapes à suivre pour dessiner une structure de lewis correctement. Pour la molécule H2O, sa structure de lewis et ces étapes sont expliquées en détail dans ce tutoriel. Parce que la molécule d’eau est simple, certaines de ces étapes ne sont pas beaucoup utilisées. Dans de tels cas, ils sont mentionnés avec les étapes respectives.,
- Trouver nombre total d’électrons de valence des coquilles d’atomes d’hydrogène et l’atome d’oxygène
- Total d’électrons de paires de lone paires et obligations
- le Centre de l’atome de sélection
- marque lone paires sur les atomes
- Marque de charges sur les atomes s’il existe.
- Vérifiez la stabilité et minimisez les charges sur les atomes en convertissant les paires solitaires en liaisons pour obtenir la meilleure structure de lewis.
Important: dessiner une structure de lewis correcte est important pour dessiner correctement les structures de résonance.,
nombre total d’électrons des coquilles de cantonnière de H2O
Il y a deux des éléments; l’hydrogène et l’oxygène. L’hydrogène est un élément du groupe IA et n’a qu’un électron dans sa dernière coquille (coquille de valence). L’oxygène est un groupe VIA élément dans le tableau périodique et contient six électrons dans sa dernière coquille. Maintenant, nous savons combien d’électrons sont inclus dans les coquilles de valence de chaque atome.,
- électrons de valence donné par les atomes d’hydrogène = 1 * 2 = 2
- électrons de valence donné par des atomes d’oxygène = 6*1 = 6
- Total d’électrons de valence = 2 + 6 = 8
Total d’électrons de valence des paires
Total d’électrons de valence paires = σ obligations + π obligations + lone paires à valence coquilles
le Total des paires d’électrons sont déterminés en divisant le nombre total d’électrons de valence par deux. Pour, H2O, les paires totales d’électrons sont 4 dans leurs coquilles de valence.,
atome central de H2O
pour être l’atome central, la capacité d’avoir une plus grande cantonnière est importante. Ensuite, à partir de l’hydrogène et de l’oxygène, quel atome a la valence la plus élevée? La valence maximale de l’oxygène est de deux. la seule valence de l’hydrogène en est une. Par conséquent, l’atome d’oxygène devrait être l’atome central de H2O. maintenant, nous pouvons dessiner un croquis de H2O pour montrer comment les atomes sont situés dans la molécule.
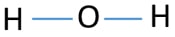
paires solitaires sur les atomes
Après avoir déterminé l’atome central et l’esquisse de la molécule H2O, nous devrions commencer à marquer les paires solitaires sur les atomes., Rappelez-vous qu’il y a au total quatre paires d’électrons.
- Il existe déjà deux liaisons H-O dans la structure d’esquisse dessinée. Maintenant, il ne reste que deux (4-2) paires d’électrons à marquer sur les atomes.
- habituellement, les paires d’électrons restantes doivent être commencées à marquer sur les atomes extérieurs. Mais dans H2O, l’atome d’hydrogène sont les atomes extérieurs qui ne peuvent pas garder plus de deux électrons dans sa dernière coquille. Par conséquent, nous ne pouvons pas marquer ces deux paires d’électrons sur les atomes d’hydrogène.,
- ensuite, marquez ces deux paires d’électrons sur l’atome central; oxygène

marquez les charges sur les atomes
Il n’y a pas de charges sur l’atome d’oxygène et les atomes d’hydrogène.
Vérifiez la stabilité et minimisez les charges sur les atomes en convertissant les paires solitaires en liaisons
comme il n’y a pas de charges sur les atomes, pas besoin de réduire les charges pour dessiner la meilleure structure de lewis. Déjà, nous avons obtenu la meilleure structure de lewis pour H2O.
Questions
quelles sont les structures de lewis similaires à l’eau peuvent être dessinées pour?,
dans la structure de lewis de la molécule d’eau, il y a deux liaisons sigma et deux paires isolées autour du sulfuratom. Le sulfure d’hydrogène, le difluorure d’oxygène (F2O) ont des structures de lewis similaires à celles de l’eau.
posez vos questions sur la chimie et trouvez les réponses
tutoriels connexes