Pyridinium chlorochromate (PCC) is a milder version of chromic acid.
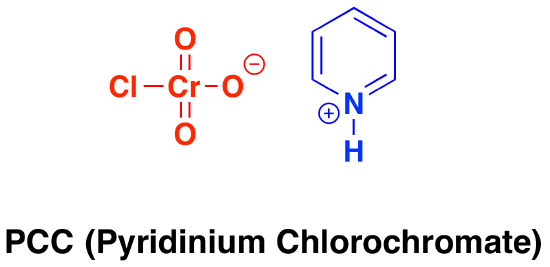
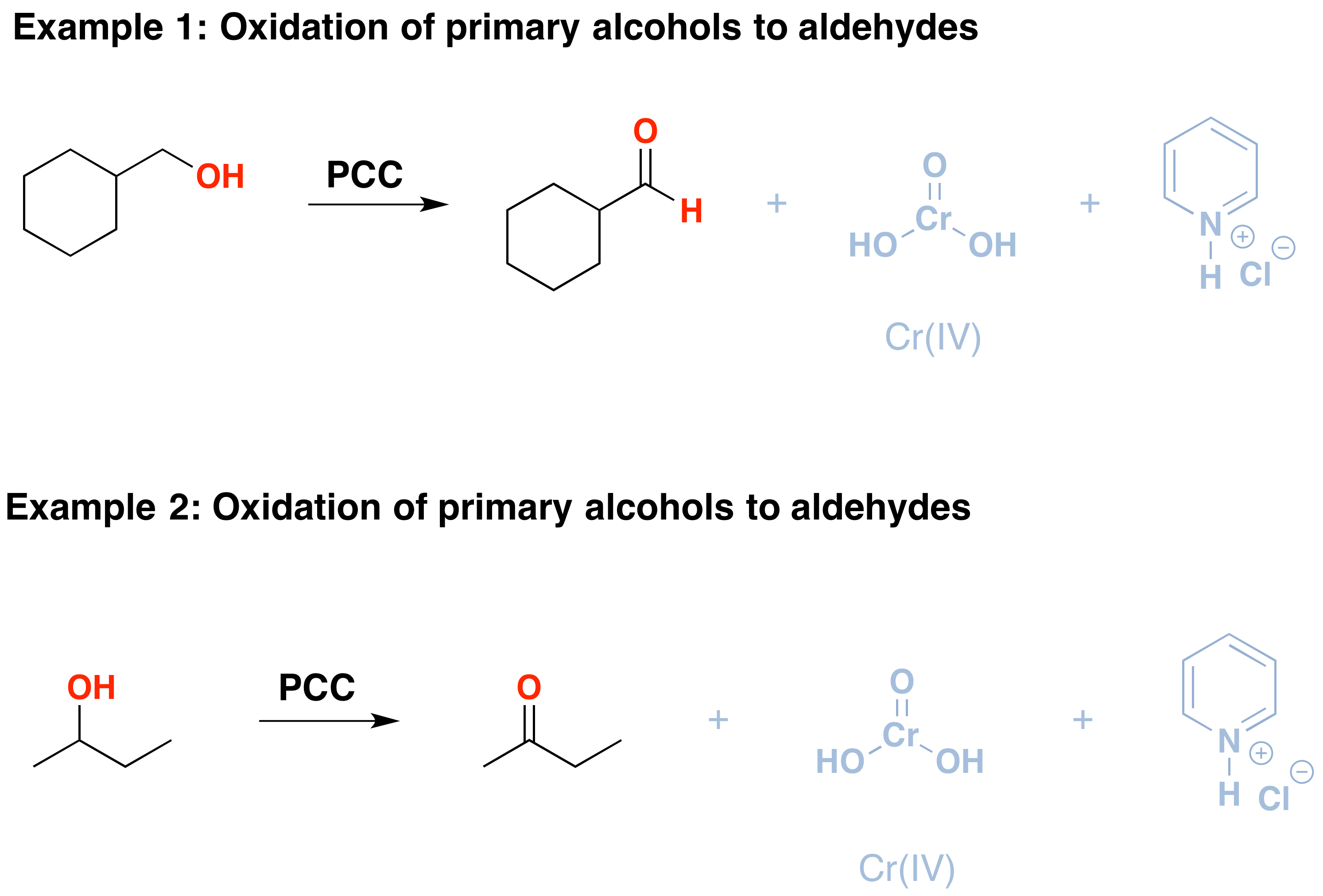
PCC oxidizes alcohols one rung up the oxidation ladder, from primary alcohols to aldehydes and from secondary alcohols to ketones. In contrast to chromic acid, PCC will not oxidize aldehydes to carboxylic acids., Similaire ou identique à: \(CrO_3\) et la pyridine (le réactif de Collins) oxydera également les alcools primaires en aldéhydes. Voici deux exemples de PCC en action.
- si vous ajoutez un équivalent de PCC à l’un de ces alcools, la version oxydée sera produite. Les sous-produits (en gris) sont le Cr (IV) ainsi que le chlorhydrate de pyridinium.
- il faut faire attention à la quantité d’eau présente dans la réaction., Si de l’eau est présente, elle peut s’ajouter à l’aldéhyde pour créer l’hydrate, qui pourrait être encore oxydé par un deuxième équivalent de PCC s’il est présent. Ce n’est pas un problème avec les cétones, car il n’y a pas de H directement lié à C.
Comment ça marche? Les réactions d’oxydation de ce type sont en fait un type de réaction d’élimination. La réaction commence par une liaison simple carbone-oxygène et se traduit par une double liaison carbone-oxygène., La réaction d’élimination peut se produire en raison du bon groupe de départ sur l’oxygène, à savoir le chrome, qui sera déplacé lorsque la liaison C-H voisine est rompue avec une base.
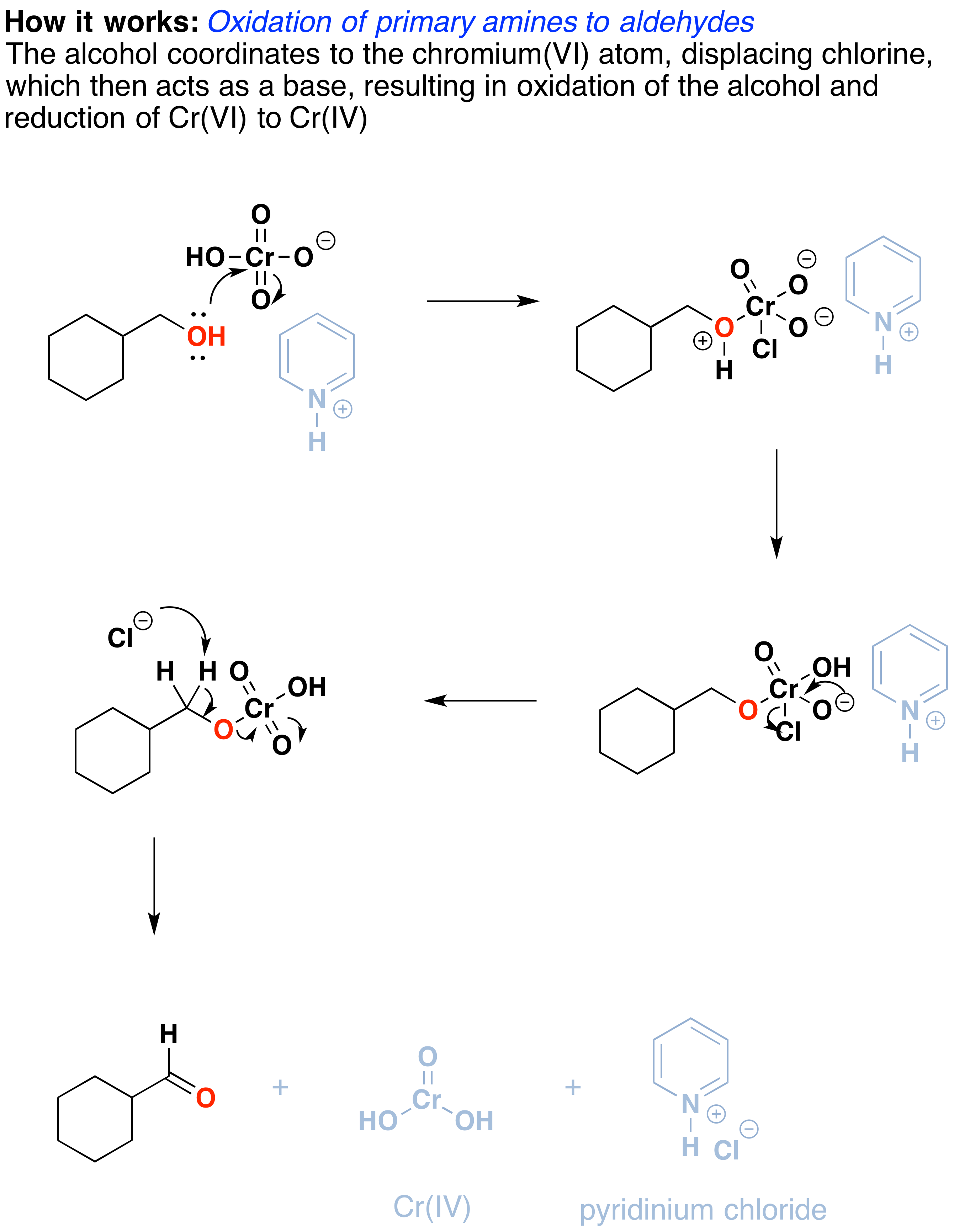
La première étape est l’attaque de l’oxygène sur le chrome pour former le Cr-O bond. Deuxièmement, un proton sur L’OH (maintenant positif) est transféré à l’un des oxygènes du chrome, éventuellement par l’intermédiaire du sel de pyridinium., Un ion chlorure est ensuite déplacé dans une réaction rappelant une réaction d’élimination 1,2 pour former ce que l’on appelle un ester de chromate.
la double liaison C-O se forme lorsqu’une base élimine le proton sur le carbone adjacent à l’oxygène. Les électrons de la liaison C-H se déplacent pour former la liaison C-O, et dans le processus, la liaison O-Cr est brisée, et Cr(VI) devient Cr(IV) (dessiné ici comme O=Cr(OH)2 ).,
notes réelles: si vous utilisez du PCC en laboratoire, n’oubliez pas d’ajouter des tamis moléculaires ou de la Celite ou un autre solide au fond du flacon, sinon vous obtenez un goudron brun désagréable difficile à nettoyer. La toxicité et le désordre associés au chrome ont stimulé le développement d’autres alternatives, telles que TPAP, IBX, DMP, et une foule d’autres réactifs que vous n’apprenez généralement pas avant l’école.
les Contributeurs
-
James Ashenhurst (MasterOrganicChemistry.com)