Introduction
La Lipase catalyse la dégradation des lipides en hydrolysant les esters des acides gras. Sa fonction est importante pour la digestion et la promotion de l’absorption des graisses dans les intestins. La Lipase se trouve principalement dans et sécrétée par le pancréas, mais se trouve également dans la salive et l’estomac.
- La lipase pancréatique (ID PDB: 1hpl) qui est représentée à droite, est une ester hydrolase carboxylique. Il est également communément appelé triacylglycérol lipase pancréatique et son numéro de classe enzymatique est E. C. 3.1.1.3 .,
- La lipase stimulée par les sels biliaires (BSSL) se trouve dans le lait maternel.
- La lipase sensible aux hormones (LIPE) hydrolyse une variété d’esters. Pour plus de détails, voir lipase sensible aux hormones.
- La monoacylglycérol lipase (MAGL) hydrolyse les triglycérides intracellulaires en acide gras et en glycérol. MAGL fonctionne avec LIPE. Pour plus de détails, voir monoglycéride lipase.
La réaction catalysée par l’enzyme est indiqué ci-dessous.
une dégradation supplémentaire entraîne finalement des 2-monoacylglycérols et des acides gras libres ., Une discussion approfondie du mécanisme peut être trouvée dans la section mécanisme catalytique de la Lipase. La détermination de la structure et de la fonction de la lipase a été un processus graduel. L’activité de la Lipase a été démontrée pour la première fois dans le pancréas par Claude Bernard en 1846. Cependant, ce n’est qu’en 1955 que Mattson et Beck ont démontré une spécificité élevée de la lipase pancréatique pour les esters primaires de triglycérides . Au cours des dernières années, la détermination de la structure cristalline de la lipase pancréatique est devenue l’objectif principal, car de nombreux scientifiques ont travaillé pour aller plus loin.,
Voir aussi
- Terrain de jeu moléculaire/lipase pancréatique
- lipase lid morph
- lipase hormonale sensible
- Lipase de Candida antarctica à l’état fermé
- lipase monoglycéride
- lipase gastrique humaine
- Lipase (Hébreu)
- métabolisme des lipides
structure
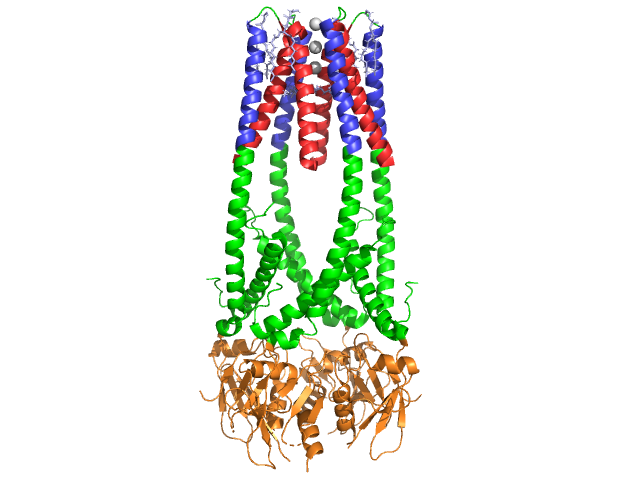
la lipase pancréatique est une protéine de 50 kDa., Alors que l’unité asymétrique cristallographique contient deux chaînes identiques, l’information (remarque 350) dans le fichier de données 1hpl indique que le dimère est un artefact de cristallisation, et que la forme fonctionnelle (également appelée assemblage biologique) est une chaîne unique (monomère). La chaîne est composée de 449 résidus . Les s de lipase (dans une sous-unité) comprennent 102 résidus qui créent 13 hélices alpha, représentées en rouge, et 139 résidus impliqués dans des feuillets bêta totalisant 28 brins, représentés en or. Les hélices alpha représentent 22% de la protéine, tandis que les feuilles bêta en représentent 30%., Chaque chaîne en contient deux bien définies . Le domaine n terminal, représenté en bleu, est caractérisé par un pli alpha/bêta hydrolase. Alors que le domaine C terminal, montré en vert, contient un sandwich de feuille bêta qui interagit avec la colipase . Chaque structure monomère et dimère de la lipase est maintenue ensemble par des liaisons disulfure, des liaisons hydrogène et des interactions électrostatiques (ponts Salins). La Lipase a 12 au total entre les résidus de cystéine. sont formés entre les nitrogènes de charge positive (bleu) dans Arg et Lys, et les oxygènes négatifs (rouge) dans les résidus Asp et Glu., (en jaune) stabilisent également l’enzyme entre les atomes de la chaîne principale et de la chaîne latérale. La Lipase a une distribution distincte des résidus (spacefill violet représente les résidus polaires). L’effondrement hydrophobe contribue à une grande partie des structures secondaires et tertiaires, car les (représentés en blanc) constituent l’intérieur de la protéine, tandis que les résidus polaires (bleu transparent) sont à la surface . En outre, la lipase en a deux . Un est enterré dans chaque sous-unité monomère. L’ion calcium est essentiel au repliement des protéines et à l’activité enzymatique ., L’image montre l’ion calcium vert dans la sous-unité A, coordonné par les résidus Glu187, Arg190, Asp192 et Asp195. La charge Ca(+2) est stabilisée par des résidus de glutamate et d’aspartate chargés négativement, et les atomes d’oxygène de deux molécules d’eau (rose).
en outre, la lipase a un unique (vert) qui empêche le solvant d’entrer dans le site actif (rouge). Le couvercle est une structure hélicoïdale à 25 résidus qui protège le trou oxyanion., Le couvercle (jaune) est particulièrement important pour la liaison au substrat car il subit un changement spectaculaire qui modifie la structure secondaire du site de liaison à la lipase de a (Site actif en rouge) à an (site actif en bleu, triacylglycéride dans spacefill) (voir lipase lid morph pour une animation de cette transition). L’ouverture du couvercle s’accompagne d’un changement de structure secondaire d’une confirmation principalement bêta-étendue à une structure où plus de la moitié du site actif est formé d’hélices alpha .,
Colipase Coenzyme
La Lipase est activée par la colipase, une coenzyme qui se lie au domaine C-terminal non catalytique de la lipase. La Colipase est une protéine de 10kDa sécrétée par le pancréas sous une forme inactive. Il a cinq conservés (montré en jaune) , et 2 – une surface hydrophile (site de lipase c-interaction terminale – montré en bleu) et une surface hydrophobe (contient plusieurs boucles hydrophobes pour combler le lipide – montré en blanc). La trypsine activera alors la colipase avant que le cofacteur puisse interagir avec la lipase.,
La Colipase doit être présente pour l’activation de la lipase et agit comme un pont entre la lipase et le lipide. Lorsque la colipase se lie, la lipase active est stabilisée pour l’interaction hydrophobe avec les triacylglycérides . En l’absence de colipase, l’accumulation d’amphiphiles à l’interface huile/eau dans le duodénum empêcherait la lipase pancréatique de se lier à son substrat. . La Colipase et la lipase sont opposées au site actif sur le C-terminal (les contacts sont des régions de rose et de jaune, avec des molécules d’eau représentées en bleu plus foncé). Les enzymes sont liées par des interactions polaires telles que , et .,
en présence de colipase, l’enzyme est activée qui déplace le (représenté en Rouge, site actif en vert) qui est composé d’acides aminés 216-239. Le volet N-terminal se déplace de manière concertée avec le domaine C-terminal pour révéler le site actif (vert), ce qui lui permet de se lier à un substrat. On suppose que cette flexibilité peut avoir une importance dans la liaison du complexe colipase-lipase avec l’interface eau-lipide. La réorganisation du volet induit également un deuxième changement conformationnel qui crée le trou oxyanion.,
mécanisme catalytique de la Lipase
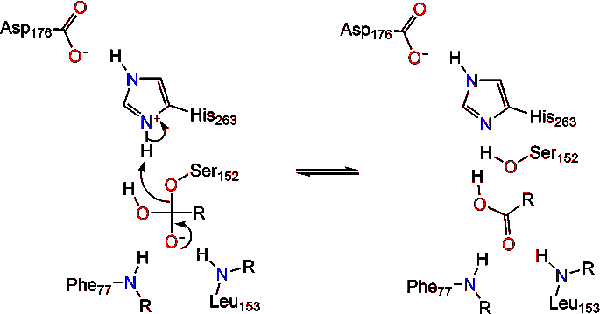
l’activation de la Lipase à l’interface lipide-eau des triacylglycérides, en présence de colipase et de sels biliaires, est appelée activation interfaciale. Pour que la réaction d’hydroloysis ait lieu, la colipase ancre la lipase à la membrane lipidique-eau de la micelle, ce qui provoque un changement de surface sur la lipase. Les quatre boucles hydrophobes de la Colipase interagissent avec l’atmosphère hydrophobe du triacylglycéride. Ceci initie la liaison du site actif au lipide et l’ouverture du couvercle pour révéler un environnement plus hydrophobe pour le triacylglycérol., Ceci à son tour, permet au triacylglycérol d’interagir avec les résidus de sites actifs clés comme la triade catalytique. Un éventail diversifié d’enzymes de lipase peut être trouvé dans la nature. Bien que les différentes formes occupent divers échafaudages protéiques, la plupart sont construits sur un pli alpha/bêta hydrolase et possèdent une chymotrypsine-like composée d’un résidu acide, d’une histidine et d’un nucléophile sérine. Dans le cas de la lipase pancréatique du cheval, la triade catalytique est composée de . Cette triade catalytique fonctionne comme la plupart des autres dans la nature., Tout d’abord, l’acide aspartique forme une liaison hydrogène avec His 263, augmentant le pKa de l’azote histidine imidazole. Cela permet à l’histidine d’agir comme une base générale puissante et de déprotoner la sérine. La sérine déprotonée peut alors servir de nucléophile et attaquer l’ester carbonyle d’un des acides gras sur les 1 ou 3 carbones de l’épine dorsale glycérol du substrat lipidique. En attaquant le lipide, un intermédiaire tétraédrique chargé négativement est formé (réaction 1). Il est stabilisé dans le trou oxyanion par deux résidus: .,
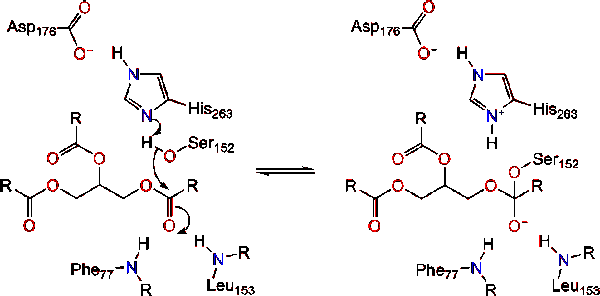
Le carbonyle se reforme avec le segment dorsal du glycérol agissant comme groupe partant (réaction 2).
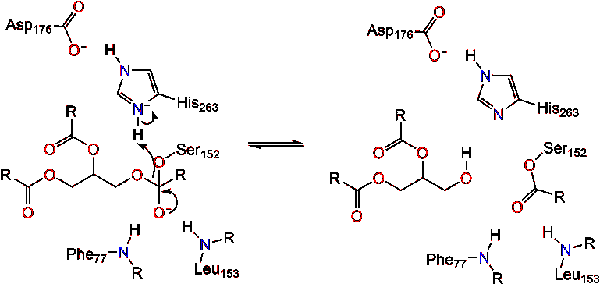
Une molécule d’eau puis donne un proton à l’histidine, la création d’un réactif de l’anion hydroxyle. L’anion hydroxyle peut alors attaquer le carbone carbonyle du lipide, formant un autre intermédiaire tétraédrique chargé négativement qui est stabilisé dans le trou oxyanion (réaction 3).,
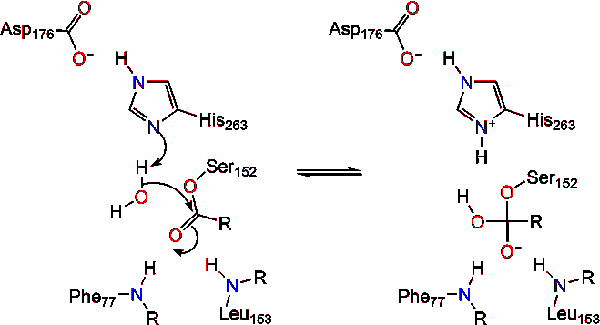
lors de la reformation du carbonyle, la sérine catalytique est libérée et les monomères de monoglycérides et d’acides gras diffusent (réaction 4).
l’Inhibition de la Lipase Pancréatique
(violet), un C11 alkyl phosphonate, est un inhibiteur compétitif de la lipase pancréatique. Il se lie directement dans la poche du site actif. Il existe également cinq molécules de B-octylglucoside (gris et rouge) qui s’associent à la lipase., MUP forme des liaisons hydrogène avec: Ser 152 et His 263, qui font partie de la triade catalytique, et Phe 77 et Leu 153 qui sont les résidus stabilisants situés dans le trou oxyanion .Le MUP a été démontré par des contacts de van der Waals avec des chaînes latérales hydrophobes Ala 178, Phe 215, Pro l80, Tyr ll4, Leu 213 (illustré en bleu).
interactions protéine – substrat
La Lipase se lie à de nombreux contacts hydrophobes. Comme on le voit ici, la lipase interagit avec le groupe alkyle du linoléate de cholestéryle via une faille hydrophobe à l’intérieur de la protéine., Ce rift oriente la molécule pour optimiser la réaction de lipolyse.
montré dans cette scène est lipase de la levure Candida rugosa dans avec deux molécules de cholestéryl linoléate (gris). Les résidus actifs du site, y compris Ser152, Asp176 et His263, sont représentés en bâtonnets rouges. La Lipase peut accueillir deux molécules lipidiques en raison du fait que ses deux sous-unités identiques catalysent une réaction identique. Une molécule de lipase peut catalyser deux réactions de lipolyse à la fois.,
Signification Clinique
la lipase Pancréatique est sécrétée dans le duodénum par le système de conduits du pancréas. Chez un individu en bonne santé, il est à très faible concentration dans le sérum. En cas de perturbation extrême de la fonction pancréatique, telle que la pancréatite ou le cancer du pancréas, le pancréas peut commencer à se digérer et à libérer des enzymes pancréatiques, y compris la lipase pancréatique, dans le sérum. La mesure de la concentration sérique de lipase pancréatique peut donc aider au diagnostic de la pancréatite aiguë.., En raison de l’activité de la lipase dans la digestion et l’absorption des graisses, il y a eu un marché croissant pour les inhibiteurs de lipase pour les produits pharmaceutiques de perte de poids. Le plus populaire est L’Orlistat (ou Xenical®) qui est un produit naturel de Streptomyces toxytricini et est le produit d’hydrogénation de la lipostation – un inhibiteur irréversible de la lipase. Cet inhibiteur agit également en liant Ser152, produisant un ester qui s’hydrolyse si lentement qu’il est pratiquement irréversible .
des Structures 3D de la Lipase
la Lipase Structures 3D