Les structures hautement organisées des protéines sont de véritables chefs-d’œuvre de l’architecture chimique. Mais les structures hautement organisées ont tendance à avoir une certaine délicatesse, et c’est vrai des protéines. La dénaturation est le terme utilisé pour tout changement dans la structure tridimensionnelle d’une protéine qui la rend incapable de remplir sa fonction assignée. Une protéine dénaturée ne peut pas faire son travail. (Parfois, la dénaturation est assimilée à la précipitation ou à la coagulation d’une protéine; notre définition est un peu plus large.,) Une grande variété de réactifs et de conditions, telles que la chaleur, les composés organiques, les changements de pH et les ions de métaux lourds peuvent provoquer une dénaturation des protéines.
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
l’Utilisation de composés organiques, tels que l’alcool éthylique, |
Ces composés sont capables de s’engager dans une liaison hydrogène intermoléculaire avec les molécules de protéines, de perturber une liaison hydrogène intramoléculaire au sein de la protéine., |
|
sels d’ions de métaux lourds, tels que le mercure, l’argent et le plomb |
ces ions forment des liaisons fortes avec les anions carboxylates des acides aminés acides ou des groupes SH de la cystéine, perturbant les liaisons ioniques et les liaisons disulfures. |
|
Alcaloïde réactifs, tels que l’acide tannique (utilisé dans le tannage du cuir) |
Ces réactifs se combinent avec les chargés positivement groupes aminés dans les protéines de perturber la liaison ionique., |
quelqu’un qui a frire un oeuf a observé la dénaturation. Le blanc d’œuf clair devient opaque à mesure que l’albumine se dénature et coagule. Personne n’a encore inversé ce processus. Cependant, compte tenu des circonstances appropriées et du temps suffisant, une protéine qui s’est dépliée dans des conditions suffisamment douces peut se replier et présenter à nouveau une activité biologique (Figure 2.5.1). De telles preuves suggèrent que, au moins pour ces protéines, la structure primaire détermine la structure secondaire et tertiaire., Une séquence donnée d’acides aminés semble adopter son arrangement tridimensionnel particulier (3D) naturellement si les conditions sont bonnes.
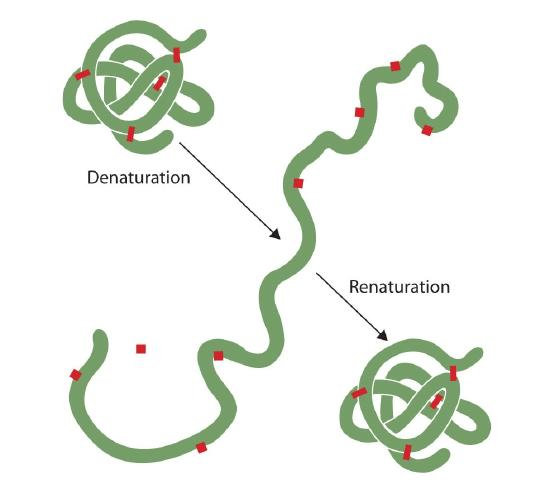
Les structures primaires des protéines sont très robuste., En général, des conditions assez vigoureuses sont nécessaires pour hydrolyser les liaisons peptidiques. Aux niveaux secondaire à quaternaire, cependant, les protéines sont très vulnérables aux attaques, bien qu’elles varient dans leur vulnérabilité à la dénaturation. Les protéines globulaires délicatement pliées sont beaucoup plus faciles à dénaturer que les protéines fibreuses et dures des cheveux et de la peau.
Résumé
les Protéines peuvent être divisés en deux catégories: fibreux, qui ont tendance à être insoluble dans l’eau, et globulaires, qui sont plus solubles dans l’eau. Une protéine peut avoir jusqu’à quatre niveaux de structure., La structure primaire se compose de la séquence d’acides aminés spécifique. La chaîne peptidique résultante peut former une hélice α ou une feuille β-plissée (ou des structures locales pas aussi facilement classées), qui est connue sous le nom de structure secondaire. Ces segments de structure secondaire sont incorporés dans la structure tertiaire de la chaîne polypeptidique pliée. La structure quaternaire décrit les arrangements des sous-unités dans une protéine qui contient plus d’une sous-unité., Quatre grands types d’interactions attractives déterminent la forme et la stabilité de la protéine pliée: la liaison ionique, la liaison hydrogène, les liaisons disulfures et les forces de dispersion. Une grande variété de réactifs et de conditions peuvent provoquer le déplier ou la dénaturation d’une protéine.