Introducere
Substituent efecte constituie un concept-cheie pentru înțelegerea de reactivitate și spectroscopice comportament de compuși organici (Krygowski & St??pień, 2005). Într-o abordare simplă, efectele substituente pot fi clasificate în funcție de mecanismul de interacțiune cu Centrul reactiv ca inductive (prin legături σ) sau efecte de rezonanță (prin legături π)., Cu toate acestea, unii termeni suplimentari (cum ar fi efectele sterice, de câmp sau de solvent) ar fi necesari pentru o descriere detaliată a efectelor substituente.
Deoarece Ingold clasificarea electronice substituent efecte (Ingold, 1953), o grupă alchil a fost privită ca o σ-donator substituentului (+I, în Ingold e nomenclatura), în cele mai multe Chimie Organică manuale (Burrows, Holman, Parsons, Pilling, & Preț, 2013; Hornback, 2006; Roos & Roos, 2014; Smith, 2013; Vollhardt & Schore, 2014)., Cu toate acestea, trebuie remarcate criticile Eğe la un punct de vedere atât de simplist:
„în apă, acidul propanoic este puțin mai slab decât acidul acetic. Natura efectului inductiv al unei grupări alchil este dezbătută de chimiști. Grupările alchil stabilizează carbocațiile și în acest rol par a fi eliberarea de electroni. Ele cresc, de asemenea, bazicitatea aminelor, sugerând din nou că acestea sunt eliberatoare de electroni. Pe de altă parte, deși alcoolul terț-butilic (pKa 19) este un acid mai slab decât etanolul (pKa 17) în apă, este acid mai puternic în faza gazoasă., Această observație experimentală sugerează că grupările alchil pot stabiliza anionii, precum și cationii și că solvarea joacă un rol important în determinarea acidității relative. Astfel, este necesar un cuvânt de precauție. Aciditățile relative pe care se bazează generalizările prezentate în acest capitol au fost determinate în apă. În faza gazoasă, se observă adesea inversări în ordinea compușilor înrudiți.”(Eğe, 1999, p. 107)
unele efecte de substituție alchil au fost adesea explicate în manuale în moduri contradictorii sau enigmatice., Astfel, deplasarea chimică diferențe între CH3 și CH2 sunt atribuite în Hornback cartea de la faptul că „carbon este mai puțin electronegativ decât hidrogenul” (Hornback, 2006, p. 549) în ciuda grup alchil au fost clasificate anterior ca un slab inductive electron-donarea de liganzi (Hornback, 2006, p. 117). În Vollhardt manual, relația dintre grup metil deplasări chimice pentru un număr de CH3X compuși și X electronegativitatea este ilustrat de o masă lipsită de o intrare pentru X=metil (Vollhardt & Schore, 2014, p., 389), evitând astfel problema incomodă a carbonului.
arăt aici că gruparea alchil se comportă ca substituent a-i + R. Deși unii factori (cum ar fi efectele câmpului, stericului sau solventului) sunt ignorați implicit în această abordare, o mulțime de dovezi teoretice și experimentale disponibile în prezent pot fi astfel descrise într-un mod ușor.
Un Cδ–Hδ+ bond de polarizare a fost observat experimental pentru metan (Lazzeretti, Zanasi, & Raynes, 1987), în mod constant, cu cea mai mare electronegativitate de carbon relativă față de hidrogen, 2.55 vs 2.,20 în scara Pauling (Allred, 1961). Astfel o polarizare modelul permite estimarea moment de dipol direcția de hidrocarburi simple prin modele aditive, deși cantitative acord este de obicei modestă (2-methylpropane: 0.3 D estimat vs 0.132 D experimentale) (Dean, 1999).deoarece hidrogenul este utilizat ca standard în clasificarea substituenților Ingold (Krygowski & St??pień, 2005), gruparea alchil ar trebui clasificată ca substituent a –I (de aici o grupă de retragere a electronilor σ). Un astfel de rol este ilustrat în Fig., 1 pentru polarizarea legăturii σ de la orice atom Y la o grupare metil, deși polarizarea legăturii inverse este de așteptat atunci când Y este mai electronegativ decât carbonul (de exemplu, clorul).
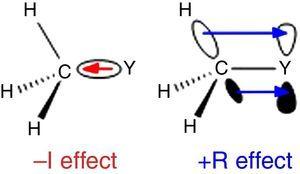
–I (stânga) și +R (dreapta) ale unei grupări metil legate de un atom Y.
Un comportament diferit este găsit pentru grupările alchil când este atașat la sp2 sau sp-hibridizat atomi din cauza de electroni densitatea de donare de alchil C–H sau C–C σ obligațiuni la gol p orbital de contiguă atom (cel mai simplu π-sistem), așa cum se arată în Fig. 1. Astfel, scăderea de fază gazoasă aciditate pentru fenol și acid benzoic prin p-metil substituție (McMahon & Kebarle, 1977) poate fi atribuit numai la o semnificativă π-donator efect de substituent metil (într-adevăr, mai mare decât cea pentru metoxi grup)., Cu toate acestea, gruparea alchil ar trebui considerată ca un substituent atipic π-donator din cauza lipsei de perechi de electroni singuri. Astfel o σ-bond/π-sistem de interacțiune, numit hyperconjugation (Mullins, 2012) poate fi ușor explicat prin analogie cu π-donator comportamentul unui singur pereche-rulment atom (de exemplu, clor) la un gol p orbital, deși C–C sau C–H obligațiuni (mai degrabă decât de electroni singuratic perechi) de grup alchil sunt implicate ca electron-eliberarea de unități în hyperconjugative interacțiuni., Interesant, π→σ* interacțiuni (negativ hyperconjugation) sunt de obicei neglijabile pentru grupările alchil lipsit electronegativ atomi (Bocca, Pontes, & Basso, 2004).unele caracteristici structurale moleculare pot fi raționalizate pe baza proprietăților grupării alchil. De exemplu, lungimile mai mari ale legăturii de CO găsite în metil cetone (acetonă: exp. 1.210 Å, calc. 1.193 Å) în comparație cu aldehidele înrudite (acetaldehidă: exp. 1.209 Å, calc. 1.,188Å) (Berry, Waltman, Pacansky, & Hagler, 1995) pot fi atribuite la stabilizarea poziția de rezonanță de formă (a se vedea Fig. 2) prin gruparea alchil π-donarea către atomul de carbon carbonilic, slăbind astfel caracteristica de legătură dublă a grupării carbonil.
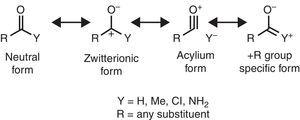
forme de rezonanță neutre (stânga) și zwitterionice (dreapta) ale unui compus carbonil.
Ca un bine-cunoscut consecință a π-donator comportamentul de grup alchil, alchil substituție randamente mai bogată în electroni alchene și arene (Libit & Hoffmann, 1974)., Reactivitatea ridicată a unui Arene substituit alchil într-o reacție SEAr poate fi astfel atribuită stabilizării intermediarului Wheland corespunzător prin donarea de π-electroni.comportamentul-I+R al grupării alchil permite explicarea unui număr de caracteristici ale compușilor substituiți cu alchil, cum ar fi momentele dipolului, proprietățile spectroscopice și reactivitatea (în faza gazoasă și în mediul de soluție), așa cum se arată mai jos.comportamentul de retragere a electronilor al grupării alchil în compușii alifatici este, de asemenea, reflectat în momentele dipolului., Astfel, vectorii moment dipol pentru propan și 2-metilpropan (Tasi și colab., 1997), precum și unele înlocuit bicyclooctanes (Böhm & Exner, 2004) poate fi atribuită la retragerea efect (–I) de grup metil în comparație cu hidrogen (vezi Fig. 3).
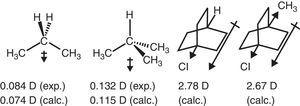
momente dipol de propan și biciclooctani substituiți.
În schimb, π-donator caracter de grupare metil (+R) este necesară în scopul de a explica ridica de dipol clipe de nitrobenzen și benzonitrile prin p-metil substituție (Maro, 1959) (vezi Fig. 4).
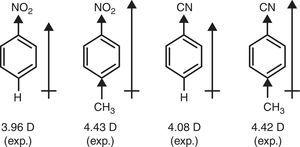
momente dipol ale derivaților de benzen.
momentele dipolului Molecular pot fi calculate în mod fiabil prin Metode computaționale curente., Interesant este că vectorii de moment dipol calculați pentru un set de hidrocarburi simple (Tasi et al., 1997) au permis deducerea unui rol dublu pentru gruparea metil: retragerea electronilor atunci când este atașată la atomii de carbon sp3, dar donarea de electroni atunci când este legată de carbonii sp2 sau sp3.un astfel de comportament dublu al substituentului alchil este de asemenea observat pentru compușii purtători de heteroatom. Astfel, o treptată moment de dipol se observă o scădere succesive de metil substituție pe amoniac (NH3, 1.47 D; MeNH2, 1.31 D; Me2NH, 1.01 D; Me3N, 0.,61 D) (Le Fčvre & Russell, 1947), în acord cu diminuarea progresivă de azot densitate de electroni (Hehre & Pople, 1970). În schimb, un moment de dipol accesoriu (de la 1.53 D la 1.68 D) (Nelson, Lide, & Maryott, 1967) este găsit pentru N,N-dimetil substituție pe anilină (Targema, Obi-Egbedi, & Adeoye, 2013), în mod constant cu creșterea π-donator de caracter pentru grupa amino (Hinchliffe & Kidd, 1980), ca urmare a +R contribuțiile de metil substituenți.,proprietățile spectroscopice ale multor compuși organici pot fi ușor raționalizate prin asumarea comportamentului a –i+R pentru gruparea alchil ca o caracteristică generală. Astfel, deplasarea chimică RMN a unui atom poate fi considerată ca o măsură experimentală a densității electronilor în poziția nucleului corespunzător, deși pot fi implicate și alte efecte – cum ar fi câmpurile magnetice anizotrope. Deplasările Downfield induse de un substituent metil pe atomii de carbon sp3 (+9,6 ppm în 13C RMN) sau atomii de hidrogen legați corespunzător (+0.,63ppm în spectrul 1H RMN) (Pretsch, Bühlmann, & Badertscher, 2009) sunt în concordanță cu comportamentul tipic –am grupuri (cum ar fi atomi de halogen).
Alchil efecte de substituție pe RMN deplasările chimice ale alchenelor arată o densitate de electroni scădere în poziția α (+12,9 la ppm pentru 13C RMN; +0.45 ppm pentru 1H RMN), precum și o densitate ridica în poziția β (-7.4 ppm pentru 13C; -0.31/-0.40 ppm pentru 1H), în mod constant, cu o –I+R efect, deși anizotrope efecte (cum ar fi inel de curenți) pot, de asemenea, juca un rol. Un astfel de comportament a-I+R se găsește și pentru alchine, conform spectroscopiei RMN 13C (+8.,5ppm pentru poziția α, -3,6 ppm pentru poziția β).comportamentul dihotomic al substituenților alchilici pe sistemele π (creșterea densității electronilor pentru atomul α, scăderea densității electronilor pentru atomul β) nu poate fi explicat pe baza unui comportament simplu (cum ar fi efectul a +I).
O –I+R de comportament (Meier 2007) se observă 15N prin spectroscopie RMN pentru alchil substituție pe amine și amide în funcție de azot hibridizare (teren schimburi pentru alifatice amine, fata de ture pentru Nsp2 purtătoare de compuși, cum ar fi anilines și amide).,
constantele de cuplare RMN sunt, de asemenea, dependente de proprietățile electronice substituente (precum și de unele caracteristici geometrice). Astfel, o scădere semnificativă este găsit pentru 1H–1H constante de cuplaj prin metil substituție (trans, -2.3 Hz; csi, -1.6 Hz; gem, -0.4 Hz), în calitate de acord cu datele din tipic electron-retragerea grupuri, cum ar fi atom de fluor (trans, -6.3 Hz; csi, -6.9 Hz; gem, -5.7 Hz). Contribuția pozitivă pentru substituția metil pe constantele de cuplare 13C-1h ale compușilor alifatici (+1.,0HZ), este, de asemenea, calitativ în concordanță cu cele din alte grupuri –i (fluor, +24Hz).spectroscopia în infraroșu este, de asemenea, sensibilă la proprietățile substituente, așa cum este ilustrat de frecvența de întindere a co a compușilor carbonil în funcție de substituentul y corespunzător, care poate fi raționalizat în ceea ce privește formele de rezonanță (Fig. 2). Prin luarea unei aldehide alifatice (ca., 1725cm–1) ca referință, redshift (număr de undă scădere) indusă de o +I substituentului (acetyltrimethylsilane, 1645cm–1: Soderquist & Hsu, 1982) pot fi atribuite la stabilizarea poziția formă. În schimb, blueshift provocat de o –am substituentului (cloruri de acil, >1800cm–1: Pretsch et al., 2009) poate fi explicată prin intermediul a două mecanisme alternative sau concurente (destabilizarea formei zwitterionice și/sau contribuția unei forme purtătoare de ioni de Aciliu). În cele din urmă, redshifts provocate de substituenții +R (amide, ca., 1680cm-1: Pretsch și colab., 2009) poate fi atribuită contribuției unei forme de rezonanță specifice. Ușoară redshift indusă de gruparea alchil (metil cetone, ca. 1715cm-1) prezintă un efect net de donare de electroni (prin urmare, o predominanță a efectului +R asupra proprietăților –I). Efectul donator net al grupării alchil legate de carbonil este în concordanță cu momentul dipol mai mare al acetonului (2.88 D) în raport cu formaldehida (2.33 D) (Nelson et al., 1967).influența grupării alchil asupra spectrelor UV-Vis a multor compuși poate fi explicată și în ceea ce privește efectele electronice., Astfel, bathochromic schimburi induse de grupe alchil la UV benzi de absorbție α,β-nesaturați compuși (+10nm în poziția α, +12nm în poziția β), poliene conjugate (+5nm) sau derivați de benzen (+3.0 nm) sunt calitativ în concordanță cu efectele tipice π-grupuri de donatori (de exemplu, clor).
faza gazoasă reactivitate acido–bazică
bazicitățile Relative ale aminelor alifatice în soluție apoasă au fost atribuite efectului presupus +I al grupării alchil (Sorrell, 2006)., Interestingly, the irregular basicity order of amines in water (Me2NH>MeNH2>Me3N>NH3, as shown by the pKa values for the corresponding conjugated acids: 10.77>10.62>9.80>9.,246) (Dean, 1999) este contaminat de solvent efecte după cum este ilustrat de sistematică bazicitatea scopul de amine în fază gazoasă (Me3N>Me2NH>MeNH2>NH3) (Brauman, Riveros, & Blair, 1971)., Deși faza de gaz bazicitatea comanda poate fi atribuită, de obicei, presupune +I alchil efect (Carter, 2007), o scădere de azot densitate de electroni prin metil substituție a fost într-adevăr respectate de către mijloacele de Potențial Electrostatic Molecular calcule (Baeten, De Proft, & Geerlings, 1995), indicând astfel o –I comportamentul pentru gruparea metil., De fapt, faza de gaz bazicitatea scopul de alifatică ar trebui să fie atribuite la creșterea stabilizare de substituit cu ioni de amoniu, datorită grup alchil polarizability (Aue, Webb, & Bowers, 1976).
Relativă a celei de alcooli în soluție apoasă (H2O>MeOH>EtOH>iPrOH>tBuOH) au fost, de asemenea, atribuită în unele manuale de presupus alchil +I efect (Johnson, 1999; Solomon, Fryhle, & Snyder, 2016)., Deoarece inversa aciditate scopul este de găsit în fază gazoasă, în raport acidități a alcoolilor în apă ar trebui să fie atribuită mai mici magnitudini de solvatare entalpiile mai mari alkoxide anioni (Brauman & Blair, 1969).discuția privind proprietățile electronice ale grupării alchil poate fi aplicată și carbanionilor. Astfel, ‘manual’ de stabilitate pentru simplu carbanions (metil>etilic>izopropilic>terț-butil) a fost atribuită presupune +I efectul inductiv de grupe alchilice (Burrows et al.,, 2013; Chaloner, 2015; Roos & Roos, 2014; Smith, 2013). Cu toate acestea, o ordine neregulata este găsit pentru fază gazoasă carbanion stabilitate (tBu>M>iPr>Et), în acord cu acordul de două deosebire de alchil efecte (DePuy et al., 1989): un mecanism de stabilizare prin alchil polarizability (care este, n→σ* hyperconjugation) și un destabilizator tendință (în mod constant cu un +R de rol, cu asumarea unei p comportament de carbon singuratic pereche).,stabilitatea altor intermediari de reacție poate fi, de asemenea, evaluată pe baza efectelor grupării alchil. Astfel, bine-cunoscut pentru stabilitate pentru carbocations (terțiar>secundar>primar>metil) a fost uneori atribuită pozitiv efectul inductiv (Chaloner, 2015; Roos & Roos, 2014)., Interesant, hyperconjugation este prezentat în mai multe manuale ca o explicație alternativă pentru stabilitatea ordinii de carbocations (Maro, Iverson, Anslyn, & Foote, 2013; Burrows et al., 2013) deși scrierea ambiguă obișnuită împiedică să se stabilească dacă ambele explicații corespund fie două descrieri diferite ale aceluiași fenomen, fie două mecanisme concurente care joacă în aceeași direcție., Oricum, de stabilitate pentru carbocations ar trebui să fie atribuită hyperconjugation (prin urmare, un+R de comportament pe un vacant p orbital, cel mai simplu π sistem), deși alte interacțiuni (cum ar fi alchil polarizability) sunt, de asemenea, implicat (Aue, 2011).radicalii liberi prezintă aceeași ordine de stabilitate ca și carbocațiile, indicând astfel stabilizarea prin substituție alchilică. Deși o astfel de stabilitate pentru a putea fi justificată pe baza unui presupus +I comportament, +R efect poate fi, alternativ, considerate, în mod analog cu stabilizarea radicalilor liberi de lone pereche purtătoare de atomi (Zipse, 2006).,
Reactivitate în soluție
Relativă acidități de simplu carboxilici acizii în soluție apoasă (acid acetic>acid propionic>acid butiric) au fost utilizate în unele manuale pentru a ilustra presupune +I efectul de grup alchil (Sorrell, 2006). Interesant, în ordinea inversă este găsit atunci când entalpiile sunt considerate (Christensen, Wojnaroski, & Hansen, 1967), indicând astfel că aciditatea ordinea în soluție apoasă ar trebui să fie atribuită hidratare entropies., Astfel, ordinea zăbrele semnificative de apă lichidă (vaporizare entropie egală cu 118,89 Jmol–1K-1, în contrast cu valorile tipice de ca. 88jmol–1k-1 pentru majoritatea lichidelor, Dean, 1999) poate introduce modificări considerabile asupra energeticii de reacție. În special, hidratarea apolar molecule (sau moieties) conduce la o nouă solvent zăbrele comanda (Blokzijl & Engberts, 1993). Ca o consecință, grup alchil inductiv efecte de date experimentale în soluție apoasă sunt adesea mascate de hidratare entropies (Calder & Barton, 1971)., Relativă acidități de simplu acizi carboxilici în fază gazoasă (Yamdagni & Kebarle, 1973) și acetonitril (Eckert et al., 2009) sunt în concordanță cu rolul major jucat de entropiile de hidratare.
aciditate mai scăzută de acid pivalic în comparație cu acid acetic, de obicei, atribuite presupune +I efectul de grup alchil (Smith, 2008), este inversată atunci când entalpiile de reacție sunt considerate (Eckert et al., 2009).,
presupusul efect al grupării alchil +I asupra acidității acizilor carboxilici simpli în soluție apoasă poate fi astfel atribuit unui artefact derivat din efectele solventului. În timp ce o creștere a volumului de soluții neutre duce la o creștere a entropiei de hidratare, relația inversă se găsește pentru speciile ionice (Graziano, 2009). În consecință, substituția alchilică (prin creșterea volumului molecular) conduce la stabilizarea (în termeni de energie liberă Gibbs) a acidului neionizat în apă, precum și la destabilizarea anionului carboxilat corespunzător, rezultând astfel o scădere a acidității.,
Cea mai mare aciditate a acidului formic în comparație cu acid acetic în soluție apoasă (valorile pKa: 3.751 și 4.756, respectiv, Dean, 1999) a fost de asemenea discutată în multe manuale ca un exemplu de aplicare de efecte inductive (Hart, Hadad, Craine, & Hart, 2012; Hornback, 2006; Okuyama & Maskill, 2014; Roos & Roos, 2014). Deoarece entalpiile de reacție foarte similare sunt implicate în reacțiile de disociere a acizilor formici și acetici (Christensen et al.,, 1967), aciditatea mai mare a acidului formic trebuie să fie într-adevăr atribuită diferențelor de entropie de hidratare.
concluzii
o înțelegere clară a efectelor inductive și de rezonanță este o cheie majoră pentru o învățare sănătoasă a chimiei organice (Mullins, 2008). În mod surprinzător, grupul alchil aproape omniprezent a fost prezentat incorect în multe manuale ca grup σ-donator (+I). Cu toate acestea, un comportament dual este demonstrat de substituenții alchil în funcție de hibridizarea atomului vecin., Astfel, grupările alchil legate de lanțurile alifatice se comportă ca σ-acceptori (–I, în mod consecvent cu electronegativitatea mai mare a carbonului în raport cu hidrogenul), în timp ce cele atașate la sistemele π acționează ca π-donori (+R, datorită interacțiunilor hiperconjugative). Un număr de date experimentale și teoretice (momente dipol, spectrele RMN, IR și UV, reactivitate) sunt de acord cu un astfel de comportament dual.,
întreaga analiză a tuturor datelor luate în considerare aici permite deducerea unui efect mic-I, precum și a unui comportament semnificativ +R pentru gruparea alchil ca caracteristică valabilă în toate discuțiile privind proprietățile spectroscopice și de reactivitate ale compușilor organici.
conflictul de interese
autorul nu declară niciun conflict de interese.