Introdução
Substituinte efeitos constituem um conceito chave para a compreensão da reatividade e espectroscópicos comportamento de compostos orgânicos (Krygowski & St??pień, 2005). Em uma abordagem simples, os efeitos substituintes podem ser classificados de acordo com o mecanismo de interação com o centro reativo como indutivos (através de ligações σ) ou efeitos de ressonância (através de ligações π)., No entanto, alguns outros termos (tais como efeitos estéricos, de campo ou de solvente) seriam necessários para uma descrição completa dos efeitos de substituição.
Desde que o Ingold classificação de eletrônica do substituinte efeitos (Ingold, 1953), o grupo alquil tem sido considerado como um σ-doadores substituinte (+I, em Ingold da nomenclatura), na maioria dos livros de Química Orgânica (Burrows, Holman, Parsons, Pilling, & Preço, 2013; Hornback, 2006; Roos & Roos, 2014; Smith, 2013; Vollhardt & Schore, 2014)., No entanto, as críticas de Eğe a um ponto de vista tão simplista devem ser comentadas:
“na água, o ácido propanóico é um pouco mais fraco do que o ácido acético. A natureza do efeito indutivo de um grupo alquilo é debatida por químicos. Grupos alquilo estabilizam carbocações e nesse papel parecem ser liberação de elétrons. Eles também aumentam a basicidade das aminas, novamente sugerindo que elas são liberadoras de elétrons. Por outro lado, embora o álcool terc-butílico (PKA 19) é um ácido mais fraco do que o etanol (PKA 17) na água, é mais forte ácido na fase gasosa., Esta observação experimental sugere que os grupos alquilo podem estabilizar aniões, bem como catiões e que a solvação desempenha um papel importante na determinação das acididades relativas. Assim, uma palavra de cautela é necessária. As acididades relativas em que se baseiam as generalizações apresentadas neste capítulo foram determinadas na água. Na fase gasosa, reversos na ordem de compostos relacionados são frequentemente vistos.”(Eğe, 1999, p. 107)
alguns efeitos de substituição de alquilos têm sido muitas vezes explicados em livros didáticos de formas contraditórias ou enigmáticas. , Assim, chemical shift diferenças entre CH3 e CH2 grupos são atribuídos no Hornback livro para o fato de que “o carbono é um pouco mais eletronegativos que o hidrogênio” (Hornback, 2006, p. 549), apesar de o grupo alquil foi anteriormente classificado como fraco indutivo elétron-doação de substituinte (Hornback, 2006, p. 117). No Vollhardt do livro didático, a relação entre o grupo metil deslocamentos químicos para um número de CH3X compostos e o X electronegativity é ilustrada pela tabela a falta de uma entrada para X=metil (Vollhardt & Schore, 2014, p., 389), evitando assim o inconveniente problema do carbono.
I show here that the alkyl group behaves as a-i+R substituent. Embora alguns fatores (como os efeitos de campo, estérico ou solvente) sejam implicitamente ignorados nesta abordagem, muitas das evidências teóricas e experimentais atualmente disponíveis podem, assim, ser descritas de uma forma fácil.
a polarização cδ–Hδ+ bond tem sido observada experimentalmente para o metano( Lazzeretti, Zanasi, & Raynes, 1987), consistentemente com a maior eletronegatividade do carbono em relação ao hidrogênio, 2.55 vs. 2.,20 na escala de Pauling (Allred, 1961). Tal padrão de polarização permite prever a direção do momento dipolar de hidrocarbonetos simples através de modelos aditivos, embora o acordo quantitativo seja geralmente modesto (2-metilpropano: 0,3 d estimado vs. 0.132 d experimental) (Dean, 1999).
Uma vez que o hidrogénio é usado como padrão na classificação de substituintes da Ingold (Krygowski & St??pień, 2005), o grupo alquilo deve ser classificado como substituinte a-I (daí um grupo σ de retirada de elétrons). Tal papel é ilustrado na Fig., 1 for The σ bond polarization from whatever atom Y to a methyl group, though the reverse bond polarization is expected when Y is a more electronegative than carbon (e.g., chlorine).
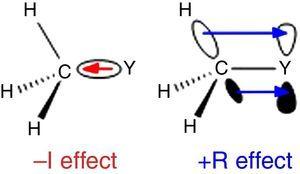
–i (esquerda) e +r (direita) efeitos de um grupo metilo ligado a um átomo Y.
Um comportamento diferente é encontrado por grupos alquilo quando ligado sp2 ou sp-hibridizado átomos devido a densidade de elétrons de doação de alquil C–H ou C–C σ títulos para o vazio orbital p do contíguos atom (o mais simples π-sistema), como mostrado na Fig. 1. Assim, a diminuição da acidez da fase gasosa do fenol e do ácido benzóico através da substituição p-metil (McMahon & Kebarle, 1977) só pode ser atribuída a um significativo efeito de dadora π Para o substituinte metil (na verdade, maior do que o do grupo metoxi)., No entanto, o grupo alquilo deve ser considerado como um substituinte de π atípico devido à falta de pares de elétrons solitários. Tal interação σ-bond / π-sistema, chamada de hiperconjugação (Mullins, 2012) pode ser facilmente explicada por analogia com o comportamento de π-doador de um átomo de par solitário (por exemplo, cloro) para um orbital p vazio, embora as ligações C-C ou C–H (em vez de pares solitários de elétrons) do grupo alquilo estão envolvidas como unidades de liberação de elétrons em interações hiperconjugativas., Curiosamente, π→σ * interações (hiperconjugação negativa) são geralmente negligenciáveis para grupos alquilo sem átomos eletronegativos (Bocca, pontos, & Basso, 2004).algumas características estruturais moleculares podem ser racionalizadas com base nas propriedades do grupo alquilo. Por exemplo, os maiores comprimentos de ligação CO encontrados em metilcetonas (acetona: exp. 1.210 Å, calc. 1.193 Å) em comparação com os aldeídos relacionados (acetaldeído: exp. 1.209 Å, calc. 1.,188Å) (Berry, Waltman, Pacansky, & Hagler, 1995) pode ser atribuída à estabilização da zwitterionic de ressonância (ver Fig. 2) através do grupo alquilo π-doação para o átomo de carbono carbonílico, enfraquecendo assim a característica de dupla ligação do grupo carbonilo.
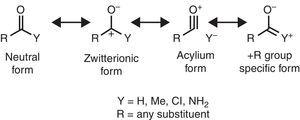
formas de ressonância neutras (esquerda) e zwitteriônicas (direita) de um composto carbonilo.
Hyperconjugative interações são dependentes do arranjo de C–H ou C–C) obrigações em relação à a p orbital do contíguos átomo Y, o mais eficaz a interação correspondente a quase um arranjo paralelo. Por exemplo, a ligação toluene Csp3–H quase perpendicular ao plano–quadro é um pouco maior que as outras ligações Csp3-H (por 0.002 Å, Hameka & Jensen, 1996)., A geometria dependência de hyperconjugation permite explicar a análise conformacional de metil-substituídas compostos insaturados, tais como o propeno (Liberles, O’Leary, Eilers, & Whitman, 1972) ou acetaldeído (Muñoz-Caro, Niño, & Moule, 1994).
As a well-known consequence of The π-Door behavior of the alkyl group, alkyl substitution yields more electron-rich alcenes and arenes (Libit & Hoffmann, 1974)., A alta reatividade de um areno Alquil-substituído em uma reação SEAr pode, portanto, ser atribuída à estabilização do Wheland correspondente intermediário através da doação de elétrons π.
The –I+R behavior of the alkyl group allows explaining a number of features of alkyl-substituted compounds, such as dipole moments, spectroscopic properties and reactivity (in gas phase and solution media), as shown below.o comportamento de retirada de elétrons do grupo alquilo em compostos alifáticos também é refletido em momentos dipólicos., Thus, the dipole moment vectors for propane and 2-methylpropane (Tasi et al., 1997), bem como alguns ciclooctanos substituídos (Böhm & Exner, 2004) podem ser atribuídos ao efeito de retirada (–I) do grupo metil em comparação com o hidrogênio (ver Fig. 3).
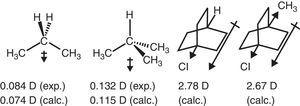
Em contraste, o valor de π-doador de caracteres do grupo metil (+R) é necessária para explicar o aumento de dipolo momentos de nitrobenzeno e benzonitrile através de p-metil substituição (Brown, 1959) (ver Fig. 4).
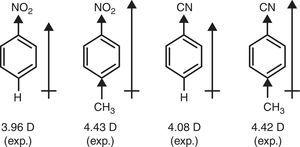
momentos dipolares moleculares podem ser calculados de forma fiável pelos métodos computacionais actuais., Curiosamente, os vetores de momento dipolo calculados para um conjunto de hidrocarbonetos simples (Tasi et al., 1997) permitiram inferir um papel duplo para o grupo metil: a retirada de elétrons quando ligados a átomos de carbono sp3, mas a doação de elétrons quando ligados a carbonos sp2 ou sp3.
tal comportamento dual do substituinte alquilo também é observado para compostos heteroátomo. Assim, uma diminuição gradual do momento dipolo é observada para a substituição de metilo sucessiva em amônia (NH3, 1.47 D; MeNH2, 1.31 D; Me2NH, 1.01 D; Me3N, 0.,61 D) (Le Fèvre & Russell, 1947), de acordo com a progressiva diminuição do nitrogênio de elétrons de densidade (Hehre & Pople, 1970). Em contraste, um momento dipolar de melhoramento (a partir de 1.53 D para 1.68 D) (Nelson, Lide, & Maryott, de 1967) é encontrado para o N,N-dimetil-substituição no anilina (Targema, Obi-Egbedi, & Adeoye, 2013), de forma consistente com o aumento do π-doador de caracteres para o grupo amino (Hinchliffe & Kidd, 1980), devido a +R contribuições de metil-substituintes.,
propriedades espectroscópicas
propriedades espectroscópicas de muitos compostos orgânicos podem ser facilmente racionalizadas assumindo um comportamento a –I+R para o grupo alquilo como uma característica geral. Thus, the NMR chemical shift of an atom can be regarded as an experimental measure of the electron density at the corresponding nucleus position though other effects-such as anisotropic magnetic fields-can also be involved. O campo descendente é induzido por um substituinte de metilo em átomos de carbono sp3 (+9,6 ppm em 13C NMR) ou os átomos de hidrogénio ligados correspondentes (+0.,63ppm in 1H NMR) (Pretsch, Bühlmann, & Bader, 2009) are consistent with the behavior of typical –I groups (such as halogen atoms).
Alquil efeitos de substituição em deslocamentos químicos de RMN de alcenos mostrar um elétron densidade diminuição α posição (+12.9 ppm para 13C RMN; +de 0,45 ppm de RMN 1H), bem como um aumento na densidade β posição (-7.4 ppm para 13C; -0.31/-0.40 ppm para 1H), consistentemente com a –I+R efeito, embora anisotrópica efeitos (tais como anel, correntes) pode também desempenhar um papel. Tal comportamento a-i+R também é encontrado para alkynes, de acordo com espectroscopia NMR 13C (+8.,5PP para a posição α, -3,6 ppm para a posição β).
o comportamento dicotómico dos substituintes alquílicos em sistemas π (aumento da densidade de elétrons para um átomo α, diminuição da densidade de elétrons para um átomo β) Não pode ser explicado com base num comportamento simples (como um efeito +I).
A –I+R comportamento (Meier, 2007), é observado através de 15N espectroscopia de RMN para alquil substituição no aminas e amidas, dependendo do nitrogênio hibridização (downfield turnos para alifáticos aminas, upfield turnos para Nsp2-rolamento de compostos, tais como anilinas e amidas).,
constantes de acoplamento NMR também dependem de propriedades eletrônicas substituintes (bem como algumas características geométricas). Assim, uma diminuição significativa é encontrada por 1H–1H constantes de acoplamento através de metil substituição de (trans, -2.3 Hz; cis, -1.6 Hz; gem, -0.4 Hz), no qualitativa de acordo com dados do típico de elétrons-retirada de grupos, tais como o átomo de flúor (trans, -6.3 Hz; cis, -6.9 Hz; gem, -5.7 Hz). The positive contribution for methyl-substitution on 13C-1H coupling constants of alifatic compounds (+1.,0Hz), é também qualitativamente consistente com os de outros grupos – I (flúor, +24Hz).a espectroscopia infravermelha também é sensível às propriedades substituintes, como ilustrado pela frequência de estiramento de co dos compostos carbonílicos como uma função do substituinte Y correspondente, que pode ser racionalizado em termos de formas de ressonância (Fig. 2). Tomando um aldeído alifático (ca., 1725cm-1) como referência, o desvio vermelho (diminuição do número de onda) induzido por um substituinte +I (acetiltrimetilsilano, 1645cm–1: Soderquist & Hsu, 1982) pode ser atribuído à estabilização da forma zwitteriônica. Em vez disso, o blueshift provocado pelo substituinte a –I (cloretos de acilo, >1800cm–1: Pretsch et al., 2009) pode ser explicado por meio de dois mecanismos alternativos ou concomitantes (desestabilização da forma zwitteriônica e/ou contribuição de uma forma de íon de acílio). Finalmente, os redshifts provocados por substituintes +R (amides, ca., 1680cm-1: Pretsch et al., 2009) pode ser atribuída à contribuição de uma forma de ressonância específica. O ligeiro desvio para o vermelho induzido pelo grupo alquilo (metilcetonas, ca. 1715cm-1) mostra um efeito líquido de doação de elétrons (portanto, uma predominância do efeito +R sobre –I propriedades). O efeito dador líquido do grupo alquilo ligado ao carbonilo é consistente com o maior momento dipolar da acetona (2,88 D) em relação ao formaldeído (2,33 D) (Nelson et al., 1967).a influência do grupo alquilo sobre os espectros UV–Vis de muitos compostos também pode ser explicada em termos de efeitos eletrônicos., Assim, mudanças batocrômicas induzidas por grupos alquilo em bandas de absorção UV de α, compostos β-insaturados (+10nm em posição α, +12nm em posição β), polienos conjugados (+5nm) ou derivados benzenos (+3.0 nm) são qualitativamente consistentes com os efeitos de grupos típicos π-doadores (por exemplo, cloro).
reactividade ácido–base de fase gasosa
basicidades relativas das aminas alifáticas em solução aquosa têm sido atribuídas ao efeito +i assumido do grupo alquilo (Sorrell, 2006)., Interestingly, the irregular basicity order of amines in water (Me2NH>MeNH2>Me3N>NH3, as shown by the pKa values for the corresponding conjugated acids: 10.77>10.62>9.80>9.,246) (Dean, 1999) é contaminado por solvente efeitos, como ilustrado pela sistemática da ordem de basicidade de aminas em fase gasosa (Me3N>Me2NH>MeNH2>NH3) (Brauman, Riveros, & Blair, 1971)., Embora a fase de gás basicidade de ordem pode ser atribuído à presume-se que +eu alquil efeito (Carter, 2007), uma diminuição de azoto densidade de elétrons através de metil substituição foi de fato observado por meio de Potencial Eletrostático Molecular cálculos (Baeten, De Proft, & Geerlings, 1995), indicando um –eu o comportamento para o grupo metil., Na verdade, a ordem de basicidade da fase gasosa das aminas alifáticas deve ser atribuída à crescente estabilização dos iões de amónio substituídos devido à polarizabilidade do grupo alquilo (Aue, Webb, & Bowers, 1976).
em relação acidities de álcoois, em solução aquosa (H2O>MeOH>EtOH>iPrOH>tBuOH) também tem sido atribuído, em alguns livros didáticos para o assumido alquil +I efeito (Johnson, 1999; Salomão, Fryhle, & Snyder, de 2016)., Uma vez que a ordem de acidez reversa é encontrada na fase gasosa, ácido relativo de álcoois na água deve ser atribuído às magnitudes mais baixas da entalpia de solvação para aniões alcóxido maiores (Brauman & Blair, 1969).
a discussão sobre propriedades eletrônicas de grupo alquilo também pode ser aplicada a carbanions. Assim, o ‘livro didático’ estabilidade para simples carbanions (metil>etil>isopropílico>tert-butil) tem sido atribuído à assumido +I efeito indutivo dos grupos alquilo (Burrows et al.,, 2013; Chaloner, 2015; Roos & Roos, 2014; Smith, 2013). No entanto, é irregular a ordem é encontrada em fase gasosa carbanion estabilidades (tBu>Me>dpi>Et), de acordo com a concordância de dois oposição de alquilo efeitos (DePuy et al., 1989): um mecanismo estabilizador através da polarizabilidade alquila (isto é, N→σ* hiperconjugação) e uma tendência desestabilizadora (consistentemente com um papel +R, assumindo um comportamento tipo p para o par solitário de carbono).,
a estabilidade de outros produtos intermédios de reacção pode também ser avaliada com base nos efeitos do grupo alquilo. Assim, o bem conhecido estabilidade para carbocations (terciário>secundário>principal>metil) tem sido atribuído às vezes a um positivo efeito indutivo (Chaloner, 2015; Roos & Roos, 2014)., Curiosamente, a hiperconjugação é apresentada em muitos livros como uma explicação alternativa para a ordem de estabilidade das carbocações (Brown, Iverson, Anslyn, & Foote, 2013; Burrows et al., 2013) embora a escrita ambígua usual impeça determinar se ambas as explicações correspondem a duas descrições diferentes do mesmo fenômeno ou dois mecanismos concorrentes que jogam na mesma direção., De qualquer forma, a ordem de estabilidade para as carbocações deve ser atribuída à hiperconjugação (daí, um comportamento a+R em um orbital p vago, o mais simples sistema π), embora outras interações (como a polarizabilidade alquila) também estão envolvidas (Aue, 2011).
radicais livres mostram a mesma ordem de estabilidade que as carbocações, indicando assim a estabilização através da substituição de alquilo. Embora tal ordem de estabilidade possa ser justificada com base em um comportamento assumido +I, O efeito +R pode ser alternativamente considerado, analogamente à estabilização dos radicais livres por átomos de par solitário (Zipse, 2006).,
reactividade na solução
ácido carboxílico simples em solução aquosa (ácido acético>ácido propiónico>ácido butírico) foram utilizados em alguns manuais para ilustrar o efeito +i assumido do grupo alquilo (Sorrell, 2006). Curiosamente, a ordem inversa é encontrada quando entalpias são consideradas (Christensen, Izatt, & Hansen, 1967), indicando assim que a ordem de acidez em solução aquosa deve ser atribuída às entropias de hidratação., Thus, the significant lattice order of liquid water (vaporization entropy equaling 118,89 Jmol–1K–1, in contrast with typical values of ca. 88Jmol-1K-1 para a maioria dos líquidos, Dean, 1999) pode introduzir mudanças consideráveis na energética de reação. In particular, hydration of apolar molecules (or movies) leads to a further solvent lattice ordering (Blokzijl & Engberts, 1993). Como consequência, os efeitos indutivos do grupo alquilo a partir de dados experimentais em solução aquosa são muitas vezes mascarados por entropias de hidratação (Calder & Barton, 1971)., Ácido relativo de ácidos carboxílicos simples em fase gasosa (Yamdagni & Kebarle, 1973) e acetonitrilo (Eckert et al., 2009) são consistentes com o papel principal desempenhado pelas entropias de hidratação.
a menor acidez do ácido pivalico em comparação com o ácido acético, geralmente atribuída ao efeito +i assumido do grupo alquilo (Smith, 2008), é revertida quando entalpias de reação são consideradas (Eckert et al., 2009).,
o efeito do grupo alquilo +I assumido sobre a acidez dos ácidos carboxílicos simples em solução aquosa pode, portanto, ser atribuído a um artefacto derivado dos efeitos do solvente. Enquanto um aumento de volume de solutos neutros leva a um aumento da entropia de hidratação, a relação inversa é encontrada para espécies iônicas (Graziano, 2009). Como consequência, a substituição alquílica (através de um aumento do volume molecular) leva à estabilização (em termos de energia livre de Gibbs) do ácido não ionizado na água, bem como a desestabilização do anião carboxilato correspondente, resultando assim uma diminuição da acidez.,
A maior acidez do ácido fórmico em comparação com ácido acético em solução aquosa (pKa valores: 3.751 e 4.756, respectivamente, Dean, 1999) também tem sido discutido em muitos livros didáticos como um exemplo da aplicação de efeitos indutivos (Hart, Hadade, Craine, & Hart, 2012; Hornback, 2006; Okuyama & Maskill, 2014; Roos & Roos, 2014). Uma vez que entalpias de reação muito semelhantes estão envolvidas nas reações de dissociação de ácidos fórmico e acético (Christensen et al.,, 1967), A maior acidez do ácido fórmico deve ser de fato atribuída às diferenças de entropia de hidratação.conclusões uma compreensão clara dos efeitos indutivos e de ressonância é uma chave importante para uma aprendizagem sólida da Química Orgânica (Mullins, 2008). Surpreendentemente, o grupo alquilo quase onipresente tem sido incorretamente apresentado em muitos livros como um grupo σ-doador (+i). No entanto, um comportamento dual é mostrado por substituintes de alquilo dependendo da hibridação do átomo vizinho., Assim, grupos alquilo ligados a cadeias alifáticas se comportam como σ-aceitadores (–i, consistentemente com a maior eletronegatividade do carbono em relação ao hidrogênio), enquanto aqueles ligados a sistemas π atuam como π-doadores (+R, devido a interações hiperconjugativas). A number of experimental and theoretical data (dipole moments, NMR, IR, and UV spectra, reactivity) agree with such a dual behavior.,
a análise completa de todos os dados considerados aqui permite inferir um pequeno efeito-I, bem como um comportamento +R significativo para o grupo alquilo como uma característica válida em todas as discussões sobre propriedades espectroscópicas e de reatividade de compostos orgânicos.
conflito de interesses
O autor não declara conflito de interesses.