Introducción
La lipasa cataliza la descomposición de los lípidos hidrolizando los ésteres de los ácidos grasos. Su función es importante para la digestión y promover la absorción de grasas en los intestinos. La lipasa se encuentra principalmente en y secretada por el páncreas, pero también se encuentra en la saliva y el estómago.
- La lipasa pancreática (PDB ID: 1hpl) que se muestra a la derecha, es una hidrolasa de éster carboxílico. También se llama comúnmente triacilglicerol lipasa pancreática y su número de clase enzimática es E. C. 3.1.1.3 .,
- La lipasa estimulada por la sal biliar (BSSL) se encuentra en la leche materna.
- La lipasa sensible a las hormonas (LIPE) hidroliza una variedad de ésteres. Para más detalles vea lipasa sensible a hormonas.
- La monoacilglicerol lipasa (MAGL) hidroliza los triglicéridos intracelulares a ácidos grasos y glicerol. MAGL funciona junto con LIPE. Para más detalles, véase monoglicérido lipasa.
La reacción catalizada por la enzima se muestra a continuación.
La descomposición adicional finalmente da como resultado 2-monoacilgliceroles y ácidos grasos libres ., Una discusión en profundidad del mecanismo se puede encontrar en la sección mecanismo catalítico de lipasa. La determinación de la estructura y función de la lipasa fue un proceso gradual. La actividad de la lipasa se demostró por primera vez en el páncreas por Claude Bernard en 1846. Sin embargo, no fue hasta 1955 que Mattson y Beck demostraron una alta especificidad de la lipasa pancreática para los ésteres primarios de triglicéridos . En los últimos años, la determinación de la estructura cristalina de la lipasa pancreática se ha convertido en el enfoque principal, ya que muchos científicos han trabajado para promover esto.,
ver también
- molecular Playground/Pancreatic Lipase
- lipase lid morph
- Hormone sensitive lipase
- Lipase from Candida antarctica in closed state
- monogliceride lipase
- Human gastric lipase
- Lipase (Hebrew)
- metabolismo lipídico
estructura
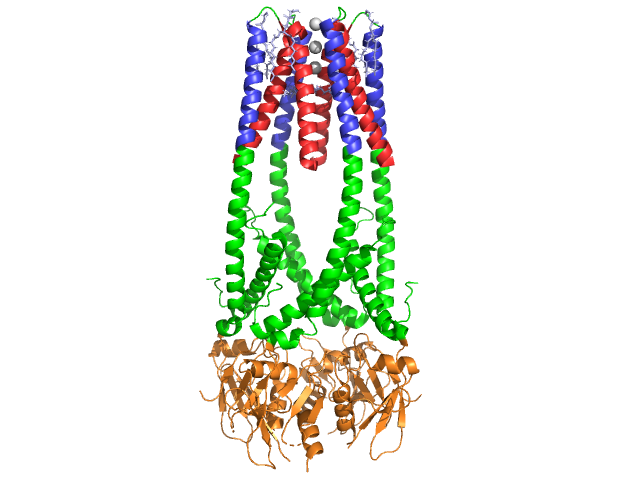
la lipasa pancreática es una proteína de 50 kDa., Mientras que la unidad cristalográfica asimétrica contiene dos cadenas idénticas, la información (observación 350) en el archivo de datos 1hpl indica que el dímero es un artefacto de cristalización, y que la forma funcional (también llamada ensamblaje biológico) es una sola cadena (monómero). La cadena está formada por 449 residuos . Las s de lipasa (en una subunidad) incluyen 102 residuos que crean 13 hélices alfa, mostradas en rojo, y 139 residuos involucrados en hojas beta que totalizan 28 hebras, mostradas en oro. Las hélices alfa representan el 22% de la proteína, mientras que las hojas beta comprenden el 30%., Cada cadena contiene dos bien definidas . El dominio terminal N, mostrado en azul, se caracteriza por un pliegue alfa / beta hidrolasa. Mientras que el dominio terminal C, mostrado en verde, contiene un sándwich de hoja beta que interactúa con la colipasa . Cada estructura de monómero y dímero de la lipasa se mantiene unida por enlaces disulfuro, enlaces de hidrógeno e interacciones electrostáticas (puentes salinos). La lipasa tiene 12 en total entre los residuos de cisteína. se forman entre los nitrogenos de carga positiva (azul) en Arg y Lys, y los oxígenos negativos (rojo) en residuos de Asp y Glu., (en amarillo) también estabiliza la enzima entre la cadena principal y los átomos de la cadena lateral. La lipasa tiene una distribución distinta de residuos (purple spacefill representa residuos polares). El colapso hidrofóbico contribuye a gran parte de las estructuras secundarias y terciarias, ya que (se muestra en blanco) conforman el interior de la proteína, mientras que los residuos polares (azul transparente) están en la superficie . Además, la lipasa tiene dos . Uno está enterrado en cada subunidad monomérica. El ion calcio es esencial para el plegamiento de proteínas y la actividad enzimática ., La imagen muestra el ion de calcio verde en la subunidad a, coordinado por residuos Glu187, Arg190, Asp192 y Asp195. La carga de Ca (+2) es estabilizada por los residuos de glutamato y aspartato cargados negativamente, y los átomos de oxígeno de dos moléculas de agua (rosa).
además, la lipasa tiene un único (verde) que bloquea el solvente de entrar en el sitio activo (rojo). La tapa es una estructura helicoidal de 25 residuos que protege el orificio oxianion., El párpado (amarillo) es especialmente importante para la Unión del sustrato, ya que sufre un cambio dramático que altera la estructura secundaria del sitio de unión de la lipasa de a (Sitio activo en rojo) a an (sitio activo en azul, triacilglicérido en el relleno espacial) (ver la transformación del párpado de lipasa para una animación de esta transición). La apertura de la tapa se acompaña de un cambio en la estructura secundaria de una confirmación en su mayoría beta extendida a una estructura donde más de la mitad del sitio activo está formado por hélices alfa .,
Colipasa coenzima
La lipasa es activada por la colipasa, una coenzima que se une al dominio C-terminal, no catalítico de la lipasa. La colipasa es una proteína 10kda secretada por el páncreas en forma inactiva. Tiene cinco conservados (se muestra en amarillo), y 2 – una superficie hidrofílica (sitio de la lipasa C-interacción terminal – se muestra en azul) y una superficie hidrofóbica (contiene múltiples bucles hidrofóbicos para tender un puente sobre el lípido – se muestra en blanco). La tripsina activará la colipasa antes de que el cofactor pueda interactuar con la lipasa.,
La Colipasa debe estar presente para la activación de la lipasa y actúa como un puente entre la lipasa y el lípido. Cuando la colipasa se une, la lipasa activa se estabiliza para la interacción hidrofóbica con los triacilglicéridos . Sin colipasa presente, la acumulación de anfífilos en la interfaz aceite / agua en el duodeno evitaría que la lipasa pancreática se uniera a su sustrato. . La colipasa y la lipasa son opuestas al sitio activo en el C-terminal (los contactos son regiones de color rosa y amarillo, con moléculas de agua mostradas en azul más oscuro). Las enzimas están unidas por interacciones polares tales como, y .,
en presencia de colipasa, se activa la enzima que mueve el (mostrado en rojo, sitio activo en verde) que se compone de aminoácidos 216-239. El colgajo N-terminal se mueve de manera concertada junto con el dominio C-terminal para revelar el sitio activo (verde), lo que le permite unirse con un sustrato. Se plantea la hipótesis de que esta flexibilidad puede tener importancia en la Unión del complejo colipasa-lipasa con la interfaz agua-lípidos. La reorganización del colgajo también induce un segundo cambio conformacional que crea el agujero oxianion.,
mecanismo catalítico de la lipasa
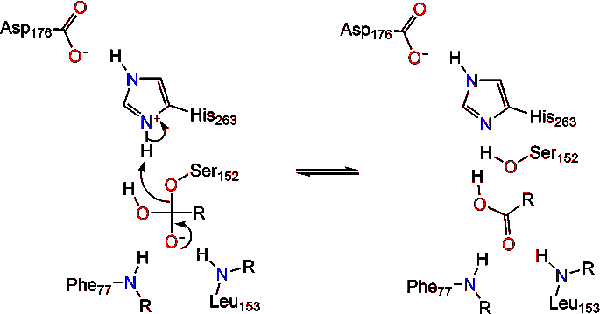
la activación de la lipasa en la interfaz lípido-agua de los triacilglicéridos, en presencia de colipasa y sales biliares, se conoce como activación interfacial. Para que tenga lugar la reacción de hidrolisis, la colipasa ancla la lipasa a la membrana lipídico-acuosa de la micela, lo que causa un cambio superficial en la lipasa. Los cuatro bucles hidrofóbicos de la colipasa interactúan con la atmósfera hidrofóbica del triacilglicérido. Esto inicia la Unión del sitio activo al lípido y la apertura de la tapa para revelar un entorno más hidrofóbico para el triacilglicerol., Esto a su vez, permite que el triacilglicerol interactúe con residuos clave del sitio activo como la tríada catalítica. Una diversa gama de enzimas lipasa se puede encontrar en la naturaleza. Aunque las diferentes formas ocupan diversos andamios de proteínas, la mayoría se construyen sobre un pliegue alfa / beta hidrolasa y poseen una quimotripsina-como compuesta de un residuo ácido, una histidina, y un nucleófilo de serina. En el caso de la lipasa pancreática de caballo, la tríada catalítica está compuesta por . Esta tríada catalítica funciona como la mayoría encontrada en la naturaleza., Primero, el ácido aspártico forma un enlace de hidrógeno con His 263, aumentando el pKa del nitrógeno de histidina imidazol. Esto permite que la histidina actúe como una poderosa base general y desprotone la serina. La serina desprotonada entonces puede servir como un nucleófilo y atacar el éster carbonilo de uno de los ácidos grasos en los 1 o 3 carbonos de la columna vertebral de glicerol del sustrato lipídico. Al atacar el lípido, se forma un intermedio tetraédrico cargado negativamente (reacción 1). Se estabiliza en el agujero oxianion por dos residuos:.,
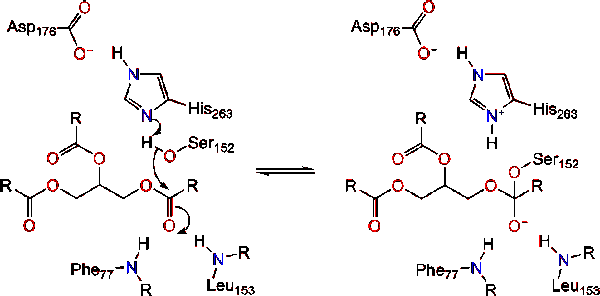
El carbonilo se reforma con el segmento troncal de glicerol actuando como el grupo saliente (reacción 2).
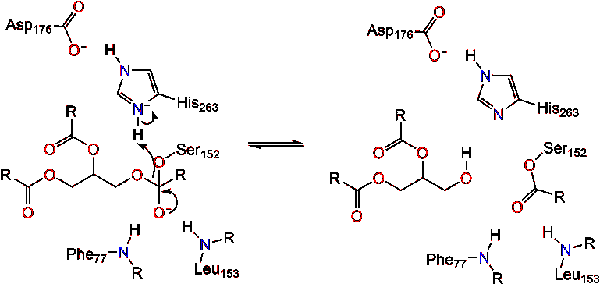
una molécula de agua luego dona un protón a la histidina, creando un anión hidroxilo reactivo. El anión hidroxilo puede entonces atacar el carbono carbonilo del lípido, formando otro intermedio tetraédrico cargado negativamente que se estabiliza en el agujero oxianion (reacción 3).,
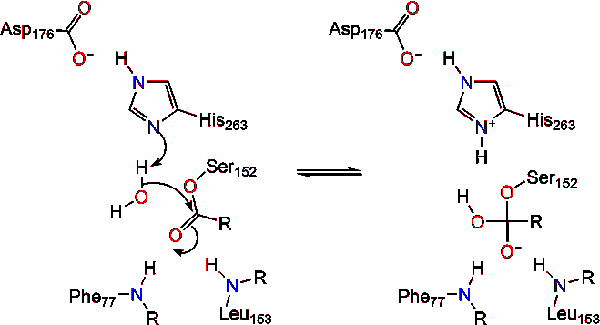
Tras la reforma de la carbonilo, la serina catalítica es liberado y monoglicéridos y ácidos grasos monómeros difusa de distancia (Reacción 4).
la Inhibición de la Lipasa Pancreática
(púrpura), una C11 alquil fosfonato, es un inhibidor competitivo de la lipasa pancreática. Se une directamente en el bolsillo del sitio activo. También hay cinco moléculas de B-octilglucósido (gris y rojo) que se asocian con la lipasa., MUP forma enlaces de hidrógeno con: Ser 152 y His 263, que son parte de la tríada catalítica, y Phe 77 y Leu 153 que son los residuos estabilizadores ubicados en el agujero oxianion .MUP fue demostrado por van der Waals contactos con cadenas laterales hidrofóbicas Ala 178, Phe 215, Pro l80, Tyr ll4, Leu 213 (se muestra en azul).
interacciones proteína – sustrato
La lipasa se une con numerosos contactos hidrofóbicos. Como se ve aquí, la lipasa interactúa con el grupo alquilo del linoleato de colesterilo a través de una grieta hidrofóbica dentro de la proteína., Esta grieta orienta la molécula para optimizar la reacción de lipólisis.
en esta escena se muestra lipasa de la levadura Candida rugosa con dos moléculas de linoleato de colesterol (gris). Los residuos del sitio activo incluyendo Ser152, Asp176, y His263 se muestran en la representación de palo rojo. La lipasa puede acomodar dos moléculas de lípidos debido al hecho de que sus dos subunidades idénticas catalizan una reacción idéntica. Una molécula de lipasa puede catalizar dos reacciones de lipólisis a la vez.,
significación clínica
La lipasa pancreática se secreta en el duodeno a través del sistema de conductos del páncreas. En un individuo sano, se encuentra a una concentración muy baja en suero. Bajo una interrupción extrema de la función pancreática, como la pancreatitis o el cáncer pancreático, el páncreas puede comenzar a digerirse y liberar enzimas pancreáticas, incluida la lipasa pancreática, en el suero. Por lo tanto, la medición de la concentración sérica de lipasa pancreática puede ayudar en el diagnóstico de pancreatitis aguda.., Debido a la actividad de la lipasa en la digestión y absorción de grasa, ha habido un mercado creciente de inhibidores de la lipasa para productos farmacéuticos para la pérdida de peso. El más popular es Orlistat (o Xenical®), que es un producto natural de Streptomyces toxytricini y es el producto de hidrogenación de la lipostación, un inhibidor irreversible de la lipasa. Este inhibidor también actúa al unirse a Ser152, produciendo un éster que se hidroliza tan lentamente que es prácticamente irreversible .
Estructuras 3D de la Lipasa
la Lipasa Estructuras 3D