소개
치환기를 효과성 개념에 대한 이해의 반응 및 분의 동작을 유기화합물(Krygowski&St??파이ń,2005). 에서 간단한 접근 방식,치환기를 효과에 따라 분류 될 수 있는 메커니즘의 상호 작용과 함께 반응 중심으로 유도(을 통해 σ-채)또는 공명 효과(통해 π-채권)., 그럼에도 불구하고,몇 가지 추가 약관(등의 입체적,현장 또는 용매를 효과)를 위해 필요한 것에 대한 철저한 설명의 치환기를 효과.
이후 Ingold 의 분류를 전자의 치환기를 효과(Ingold,1953),의 알킬 그룹으로 간주되었습 σ-기증자의 치환기(+I,에 Ingold 의 명칭)에서 가장 유기화학 교과서(굴,홀맨,파슨스,필링,&가 2013 년;Hornback,2006;Roos&로스,2014;스미스,2013 년; Vollhardt&Schore,2014)., 그럼에도 불구하고,Eğe 의 비판하는 단순한 관점에 주목해야한다.
“에서 물,propanoic 산은 약간보다 약한 아세트산입니다. 알킬기의 유도 효과의 본질은 화학자들에 의해 논의된다. 알킬기는 카보 코트를 안정화시키고 그 역할에서 전자 방출 인 것으로 보인다. 그들은 또한 아민의 염기성을 증가시켜 다시 전자 방출임을 시사한다. 다른 한편으로,하지만 tert-부틸 알코올(pKa19)은 약한 이상으로 산탄올(pKa17)에서 물,그것은 강산의 가스 단계입니다., 이 실험적인 관찰이 있듯이 보다 알킬기를 안정시킬 수 있습 음이온뿐만 아니라 양이온과는 solvation 에서 중요한 역할을 결정하는 상대 acidities. 따라서주의의 단어가 필요합니다. 이 장에서 제시된 일반화가 기초가되는 상대적 산성은 물 속에서 결정되었다. 가스 단계에서는 관련 화합물의 순서로 역전이 종종 보입니다.”(Eğe,1999,p.107)
일부 알킬 치환 효과는 종종 모순되거나 수수께끼 같은 방식으로 교과서에서 설명되었다., 따라서,화학적 변화 사이에 차이 CH3 및 CH2 그룹인에 Hornback 의 책이라는 사실에는”탄소는 약간 더 음전기보다는 수소”(Hornback,2006,p. 549)에도 불구하고 알킬기 이전에으로 분류 약 유도자-기부 치환기(Hornback,2006,p. 117). 에 Vollhardt 의 교과 사이의 관계를 메틸 그룹이 화학적 변화의 수에 대한 CH3X 화합물과 엑 전기 음성이 나와 테이블에 의해 부족에 대한 항목 X=메틸(Vollhardt&Schore,2014,p., 389),따라서 불편한 탄소 문제를 피한다.
알킬기가 a–I+R 치환기로서 작용한다는 것을 여기서 보여준다. 하지만 일부 요인들(예:필드 입체적 또는 용매를 효과)는 암시적으로 무시에 이 방법은,많은 현재 사용할 수 있는 이론적 및 실험적 증거할 수 있습에서 설명하는 쉬운 방법입니다.
A Cδ–Hδ+채 양극화가 되어 실험적으로 관찰해 메탄(Lazzeretti,Zanasi,&Raynes,1987),지속적으로 더 큰 전기 음성도의 상대적인 탄소는 수소,2.55 대 2.,20 폴링 규모(Allred,1961). 그런 편광 패턴을 예측하기 쌍극자 모멘트 방향으로의 간단한 탄화수소를 통해 첨가물이 모델,그 양이 많은 계약은 일반적으로 겸손(2-methylpropane:0.3D 예상 대 0.132D 실험)(딘,1999).
Ingold 의 치환체 분류에서 수소가 표준으로 사용되기 때문에(Krygowski&St??pień,2005),알킬기는 a–I 치환기(따라서 σ 전자 인출 기)로 분류되어야한다. 이러한 역할은도 1 에 도시되어있다., Y 가 탄소(예:염소)보다 더 전기 음성도 일 때 역 결합 분극이 예상되지만,어떤 원자 Y 에서 메틸 그룹으로의 σ 결합 분극에 대해 1.
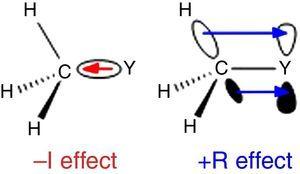
–원자에 결합 된 메틸기의 I(왼쪽)및+R(오른쪽)효과 Y.
는 다른 행동을 발견한 알킬 그룹에 연결할 때에는 sp2 또는 sp-교배 및 원자로 인해 전자 밀도부에서 알킬 C H C C σ 채권 빈 p 궤도의 연속 원자(가장 간단한 π 시스템),그림에서와 같이. 1. 따라서,의 감소한 가스 단계를 산성도에 대한 페놀과 벤조산을 통해 p-메틸 교체(혼&Kebarle,1977)수에 기인하는 중요한 π-기증자에 대한 효과 메틸 치환기(실제로는 더 큰 것보다는 대한 methoxy 그룹)., 그러나,알킬기는 고독한 전자쌍의 부족으로 인해 비정형 γ-공여체 치환기로 간주되어야한다. 이러한 σ-bond/π 시스템용으로 지명 hyperconjugation(멀,2012)을 쉽게 설명한 비유하여 π-기증자의 행동이의 고독한 쌍은 베어링 원자(예를 들어,염소)빈 p 궤도만,C–C 또는 C–H bonds(보다 전자는 고독한 쌍)의 알킬 그룹으로 참여 전자 방출 단위에서 hyperconjugative 상호 작용합니다., 흥미롭게도,π→σ*상호 작용(음 hyperconjugation)일반적으로 무시할에 대한 알킬 그룹이 부족한 부위의 원자(보카,Pontes,&Basso,2004).
일부 분자 구조적 특징은 알킬기 특성에 기초하여 합리화 될 수있다. 예를 들어,메틸 케톤에서 발견되는 더 큰 공동 결합 길이(아세톤:exp. 1.210Å,석회질. 1.193Å)관련 알데히드(아세트 알데히드:exp. 1.209Å,석회질. 1.,188Å)(Berry,Waltman,Pacansky,&Hagler,1995)는 zwitterionic 공명 형태의 안정화에 기인 할 수있다(그림 1 참조). 2)알킬기를 통해 γ-카보 닐기 탄소 원자에 기증하여 카보 닐기의 이중 결합 특징을 약화시킨다.
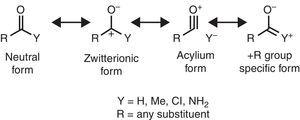
카르보닐 화합물의 중성(왼쪽)및 zwitterionic(오른쪽)공명 형태.
Hyperconjugative 상호 작용에 의존하는 배열의 C–서(또는 C–C)채권에 상대적 p 궤도의 연속 원자 Y,가장 효과적인 상호 작용에 해당하는 거의 병렬로 배열. 예를 들어,톨루엔 Csp3–H 채권 거의 수직 프레임워크를 위한 비행기가 약간 다른 것 보다 더 Csp3H 채권(의 0.002Å,Hameka&Jensen,1996)., 기존의 hyperconjugation 할 수 있습을 설명하는 구조적 분석의 메틸-대체 불포화 화합물과 같은 프로필렌(Liberles,오리어리,Eilers,&Whitman,1972)또는 아세트알데히드(노즈-Caro,니뇨,&Moule,1994).
으로 잘 알려진 결과의 π-기증자의 동작을 알킬 그룹,알킬 대체 수익률이 더 많은 전자이 풍부한 외과 성급(Libit&호프만,1974)., 높은 반응의 알킬 대체 arene 서로 반응할 수 있습 따라서 수인의 안정화 해당 Wheland 중급을 통해 π 전자니다.
–I+R 의 동작을 알킬 그룹이 있습을 설명하는 기능의 알킬 대체 화합물과 같은 쌍극자 순간,분광학적 특성 및 반응성(에서 가스 단계 및 미디어 솔루션),같은 아래와 같습니다.
쌍극자 모멘트
지방족 화합물에서 알킬기의 전자 철회 거동은 또한 쌍극자 모멘트에 반영된다., 따라서,프로판 및 2-메틸 프로판에 대한 쌍극자 모멘트 벡터(Tasi et al.,1997),뿐만 아니라 일부 대체 bicyclooctanes(재직&북대서양 진,2004)에 기인할 수 있습을 철수하는 효과(–나)의 메틸에 비소와(그림을 참조하십시오. 3).
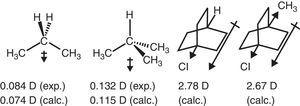
프로판 및 치환 된 바이 사이클로 옥탄의 쌍극자 모멘트.나는 이것을 할 수 없다.,
반면에,π-기증자의 문자 메틸(+R)하기 위해 필요 설명의 쌍극자의 순간 nitrobenzene 및 benzonitrile 을 통해 p-메틸 교체(갈색,1959)(그림을 참조하십시오. 4).
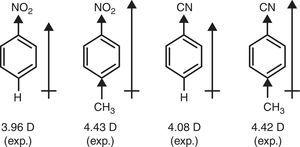
벤젠 유도체의 쌍극자 모멘트.나는 이것을 할 수 없다.
분자 쌍극자간 신뢰성 있게 계산해 현재 전산 방법이 있습니다., 흥미롭게도,단순 탄화수소 세트에 대한 계산 된 쌍극자 모멘트 벡터(Tasi et al.,1997)가 허용되는 유추를 이중 역할에 대한 메틸:전자 인출할 때에 부착 sp3 탄소수지만,전자-기부하는 경우 바인딩 sp2 또는 sp3 탄소.
알킬 치환기의 이러한 이중 거동은 헤테로원자-베어링 화합물에 대해서도 관찰된다. 따라서,의 점진적인 쌍극자 모멘트 감소가 관찰한 연속적인 대체 메틸 암모니아(NH3,1.47D;MeNH2,1.31D;Me2NH,1.01D;Me3N0 입니다.,61D)(Le Fèvre&러셀,1947 년),에서 계약을 진행 감소 질소의 전자 밀도(Hehre&Pople,1970). 반면,쌍극자 모멘트 향상(1.53D1.68D)(넬슨,Lide,&Maryott,1967 년)발견한 N,N-dimethyl 대체에 아닐린(Targema,오비 Egbedi,&Adeoye,2013), 와 함께 지속적으로 절상의 π-증 문자를 위한 아미노 그룹(Hinchliffe&키드,1980)인+R 의 기여 메틸 치환기.,
분 속성을
분광학적 특성은 많은 유기 화합물의 수 있게 합리화 가정하여 a–I+R 행동에 대한 알킬 그룹으로 일반적인 기능입니다. 따라서,NMR 화학적 변화의 원자로 간주될 수 있는 실험의 측정은 전자 밀도에 해당하는 핵을 위치지만 다른 효과 같은 이방성 자기장에도 참여합니다. Sp3 탄소 원자(13C NMR 에서+9.6ppm)또는 상응하는 결합 된 수소 원자(+0.,1H NMR 의 63ppm)(Pretsch,Bühlmann,&Badertscher,2009)는 전형적인–I 그룹(예:할로겐 원자)의 거동과 일치합니다.
알킬 대체 효과에 NMR 화학적 변화의 알켄 쇼 전자밀도가 감소 α 위치(+12.9ppm13C NMR;+0.45ppm1H NMR)뿐만 아니라,밀도를 높이에 위치는 β(-7.4ppm13C;-0.31/-0.40ppm1),지속적으로 a–I+R 효과,비록 이방 효과(와 같은 링류)도 또한 역할을 할 수 있습니다. 이러한 a-i+R 거동은 13C NMR 분광법(+8.,Α 위치의 경우 5ppm,β 위치의 경우 -3.6ppm).
이분법 행동의 알킬 치환 π 시스템(전자 밀도를 높 α 원자,전자 밀도는 감소한 β 원자)설명할 수 없는 기준으로는 간단한 동작(예:+I 효과).
A–I+R 동작(마이어,2007 년)를 관찰을 통해 15N NMR 분광기에 대한 알킬 대체에 아민과 아미드에 따라 질소 교잡(다운 필 변화를 위한 방향족 아민,업 필드에 대한 변화를 Nsp2-품 화합물과 같은 anilines 과 아미드).,
NMR 결합 상수는 또한 치환 전자 특성(뿐만 아니라 일부 기하학적 특징)에 의존한다. 따라서,상당한 감소가 발견되 1H–1 연결 상수를 통해 메틸 교체(트랜스,-2.3Hz;cis,-1.6Hz,보석,-0.4Hz),질적 계약에서 데이터와 함께 전형적인 그룹 전자 철수와 같은 불소 atom(트랜스,-6.3Hz;cis,-6.9Hz,보석,-5.7Hz). 지방족 화합물의 13c-1H 커플 링 상수에 대한 메틸 치환에 대한 양의 기여(+1.,0Hz),또한 다른–I 그룹(불소,+24Hz)의 사람들과 질적으로 일치합니다.
적외선 분광학도에 민감한 치환기 속성으로,도시에 의해 스트레칭 주파수의 카르보닐 화합물의 함수로 해당 치환기 Y,할 수 있는 합리화의 측면에서 공진 형태(Fig. 2). 지방족 알데히드(ca., 1725cm–1)참고로,이는 적색(wavenumber 감소)에 의해 유도 된+내가 치환기(acetyltrimethylsilane,1645cm–1:Soderquist&Hsu,1982)에 표시 될 수 있습의 안정화 zwitterionic 형태입니다. 대신,a–I 치환기에 의해 유발 된 blueshift(아실 클로라이드,>1800cm-1:Pretsch et al. 2009 년)설명할 수 있에 의해 두 개의 대나 동시 메커니즘(의 불안정 zwitterionic 양식 및/또는 기여의 acylium 이온 베어링 형식). 마지막으로,+R 치환체(amides,ca., 1680 센치메터-1:Pretsch 등.,2009)는 특정 공명 형태의 기여에 기인 할 수있다. 알킬기에 의해 유도 된 약간의 적색 편이(메틸 케톤,ca. 1715cm-1)은 순 전자 기증 효과를 나타낸다(따라서+R 효과 over-I 특성의 우세). 카르 보닐 결합 알킬기의 순 공여 효과는 포름 알데히드(2.33D)에 비해 아세톤(2.88D)의 더 큰 쌍극자 모멘트와 일치한다(Nelson et al., 1967).
많은 화합물의 UV–Vis 스펙트럼에 대한 알킬기의 영향은 또한 전자 효과의 관점에서 설명 될 수있다., 따라서,bathochromic 교대에 의해 유도된 알킬 그룹에 자외선 흡수 밴드의 α,β-불포화 화합물(+10nm α 위치,+12nm 에 β 위치),복합 polyenes(+5nm)또는 유도체 벤젠(+3.0nm)는 질적으로 일관의 효과적인 π-기증자 그룹(예를 들어,염소).
기체 상 산–염기 반응성
수용액에서 지방족 아민의 상대적 염기성은 알킬기의 가정 된+I 효과에 기인 한 것이다(Sorrell,2006)., Interestingly, the irregular basicity order of amines in water (Me2NH>MeNH2>Me3N>NH3, as shown by the pKa values for the corresponding conjugated acids: 10.77>10.62>9.80>9.,246)(딘,1999)가에 의해 오염된 용제 효과에 의해 그림으로 체계적인 염기도 순서 아민 가스 단계(Me3N>Me2NH>MeNH2>NH3)(Brauman,리베로 스,&블레어,1971)., 하지만 가스 단계는 염기도 순서에 기인할 수 있는 일반적으로 가정+내가 알킬 효과(Carter,2007 년),감소 질소의 전자 밀도를 통해 메틸 대체되었다는 참으로 관찰에 의하여 분자의 정전기 잠재적인 계산을(Baeten,드 Proft,&Geerlings,1995),따라서를 나타내는–나는 행동에 대한 메틸 그룹입니다., 실제로,가스 단계는 염기도 순서 방향족 아민해야에 기인하는 증가의 안정화 대체 암모늄이온으로 알킬 그룹 polarizability(Aue,Webb,&Bowers,1976).
상대적인 acidities 에서 알콜의 수용액(H2O>MeOH>알코올>iPrOH>tBuOH)인한 것이었에서 교과서으로 알킬+I 효과(Johnson,1999;솔로몬,Fryhle, &Snyder,2016)., 이후 역 산성도 주문이에서 발견한 가스 단계,상대 acidities 의에서 알콜 물에 기인한다 낮은 크기의 solvation enthalpies 에 대한 큰 알콕사이드 음이온(Brauman&블레어,1969).
알킬기 전자 특성에 대한 논의는 또한 카바 니온에도 적용될 수있다. 따라서,’교과서에’안정성 순서를 위한 간단한 carbanions(메틸>에틸>이소프로필>tert-부틸)되었습에 기인한다고 가정+저는 유도적인 효과의 알킬기(굴 et al., 그러나,나는 이것이 어떻게 작동 하는지를 알아 내려고 노력할 것입니다. 그러나,불규칙한 순서가 발견한 가스 단계 carbanion 안정성(tBu>나>iPr>Et),와의 계약에 동의 두 개의 반대 알킬 효과(DePuy et al. 1989 년):안정화 메커니즘을 통해 알킬 polarizability(즉,n→σ*hyperconjugation)및 불안정 트렌드(지속적으로 함+R 역할,가정에 의해 p-처럼 행동에 대한 탄소 lone pair).,
다른 반응 중간체의 안정성은 또한 알킬기 효과에 기초하여 평가 될 수있다. 따라서,잘 알려진 안정성을 위해 carbocations(tertiary>보조>기본>메틸)된 때에 기인한 긍정적인 유도 효과(Chaloner,2015 년;Roos&로스,2014)., 흥미롭게도,hyperconjugation 시에서 많은 교과서에 대한 대안으로 설명한 안정성의 순서 carbocations(브라운,아이버슨,Anslyn,&풋,2013 년;굴 et al. 2013 년)지만 일반적인 모 쓰기 방지 확인하는지 여부를 모두 설명 중 하나에 해당하는 두 개의 다른 설명이 동일한 현상 또는 두 가지 메커니즘이 동시에서 재생됩니다., 어쨌든,안정기에 대한 carbocations 에 기인한 hyperconjugation(따라서,+R 행동에서 빈 p 궤도,간단한 π 시스템),지 다른 상호 작용(와 같은 알킬 polarizability)도 참여하고(아우,2011).
자유 라디칼은 carbocations 와 동일한 안정성 순서를 나타내므로 알킬 치환을 통한 안정화를 나타냅니다. 하지만 이러한 안정성을 위해 정당화 될 수 있습을 기준으로 간주+내가 동작+R 효과될 수 있습으로 간주,유사하의 안정화 활성 산소에 의해 고독한 쌍은 베어링 원자(Zipse,2006).,
반응성 솔루션을
상대적인 acidities 의 카르복시산 수용액에(아세트산>프로피온산>부티르산)에 사용되었습에서 교과서를 설명하기 위해 가정+저는 효과의 알킬 그룹(피오,2006). 흥미롭게도,반대의 순서가 발견된 경우 enthalpies 는 대신 간주(크리스텐슨,Izatt,&Hansen,1967),따라서는 것을 나타내는 산성도 순서를 수용액에 기인한 수분 entropies., 따라서,ca 의 전형적인 값과 대조적으로,액체 물(118.89Jmol–1K–1 에 해당하는 기화 엔트로피)의 중요한 격자 순서. 대부분의 액체에 대해 88Jmol–1K–1,Dean,1999)는 반응 에너지학에 상당한 변화를 도입 할 수 있습니다. 특히,수화의 apolar 분자(또는 moieties)리드하는 추가로 용매 격자 주문(Blokzijl&Engberts,1993). 결과적으로 알킬 그룹 유도 효과 실험 데이터에서는 수용액은 종종 마스크에 의해 수분 entropies(칼더&Barton,1971)., 가스상에서의 단순 카르 복실 산의 상대적 산성도들(Yamdagni&Kebarle,1973)및 아세토 니트릴(Eckert et al.,2009)는 수화 엔트로피에 의해 수행되는 주요 역할과 일치한다.
일반적으로 알킬기(Smith,2008)의 가정 된+I 효과에 기인 한 아세트산과 비교하여 피발 산의 낮은 산도는 반응 엔탈피가 고려 될 때 역전된다(Eckert et al., 2009).,
가정+내가 알킬 그룹에 대한 효력의 산성도 간단한 카르복시산 수용액에 따라서 기인하는 이슈에서 파생된 용제 효과. 중성 용질의 부피 증가는 수화 엔트로피 상승을 초래하는 반면,이온 종에 대해서는 역 관계가 발견된다(Graziano,2009). 결과적으로 알킬 대체(증가를 통해의 분자량)리드하여 안정화(에 깁스 무료 에너지 측면)의 비이온산에서 물뿐만 아니라 환경을 보호해 지구를 구의는 해당 카복실산 음이온,따라서 결과는 산성이 감소합니다.,
더 큰 산의 포름산서와 비교 아세트산에 수용액(pKa 값:3.751 및 4.756,각각 딘,1999)또한 많은 교과서에서 설명한 예로의 응용 프로그램의 유도 효과(하트,하닷,Craine,&Hart,2012;Hornback,2006;오카야마&Maskill,2014; Roos&로스,2014). 매우 유사한 반응 엔탈피가 포름산과 아세트산의 해리 반응에 관여하기 때문에(Christensen et al.,,1967),포름산의 더 큰 산도는 실제로 수화 엔트로피 차이에 기인해야합니다.
결론
유도 및 공명 효과에 대한 명확한 이해는 유기 화학의 건전한 학습을위한 주요 열쇠입니다(Mullins,2008). 놀랍게도,거의 유비쿼터스 알킬 그룹은 많은 교과서에서 σ-공여체(+I)그룹으로 잘못 제시되었다. 그러나,이중 거동은 이웃 원자의 혼성화에 따라 알킬 치환기에 의해 나타난다., 따라서,알킬기를 바인딩 방향족 체인 행동으로 σ-수락자(–I,지속적으로 더 큰 전기 음성도의 상대적인 탄소는 수소),반면에 부착된 π 시스템으로 행동 π-기증자(+R,인 hyperconjugative 상호 작용). 다수의 실험 및 이론 데이터(쌍극자 모멘트,NMR,IR 및 UV 스펙트럼,반응성)는 이러한 이중 동작에 동의합니다.,
전체 분석의 모든 데이터는 여기서 고려할 수 있습 유추를 작은 나는 효과뿐만 아니라는 뜻깊+R 행동에 대한 알킬로 그룹 기능을 모든 유효한 토론에서 분광과 반응의 속성 유기 화합물입니다.
이해 상충
저자는 이해 상충이 없다고 선언합니다.피>