Bevezető
Szubsztituens hatások képeznek kulcs fogalom a megértés, a reaktivitás, valamint spektroszkópiai viselkedés szerves vegyületek (Krygowski & St??pień, 2005). Egy egyszerű megközelítésben a szubsztituens hatásokat a reaktív központtal való kölcsönhatás mechanizmusa szerint induktív (σ-kötéseken keresztül) vagy rezonancia hatások (π-kötéseken keresztül) osztályozhatók., Mindazonáltal a szubsztituens hatások alapos leírásához további feltételekre lenne szükség (például steric, field vagy solvent effects).
Mivel a Ingold minősítését elektronikus szubsztituens hatások (Ingold, 1953), az alkil csoport már tekinteni, mint egy σ-donor szubsztituens (+I, a Ingold van nómenklatúra) a legtöbb Szerves Kémia tankönyvek (Burrows, Holman, Parsons, Pilling, & Ár, 2013; Hornback, 2006; Roos & Roos, 2014; Smith, 2013; Vollhardt & Schore, 2014)., Mindazonáltal meg kell jegyezni az Eğe kritikáját egy ilyen egyszerű szempontból:
“vízben a propánsav kissé gyengébb, mint az ecetsav. Az alkilcsoport induktív hatásának természetét a vegyészek vitatják meg. Az alkilcsoportok stabilizálják a karbokációkat, és ebben a szerepben elektron felszabadulásnak tűnnek. Növelik az aminok bázikusságát is, ami ismét arra utal, hogy elektronfelszabadítóak. Másrészről, bár a terc-butil-alkohol (pKa 19) gyengébb sav, mint az etanol (PKA 17) vízben, erősebb sav a gázfázisban., Ez a kísérleti megfigyelés arra utal, hogy az alkilcsoportok stabilizálhatják az anionokat, valamint a kationokat, és hogy a szolváció fontos szerepet játszik a relatív savak meghatározásában. Ezért óvatosságra van szükség. Az ebben a fejezetben bemutatott általánosítások alapjául szolgáló relatív savasságot vízben határoztuk meg. A gázfázisban gyakran fordulnak elő a kapcsolódó vegyületek sorrendjében.”(Eğe, 1999, p. 107)
néhány alkilhelyettesítő hatást gyakran magyaráztak a tankönyvekben ellentmondásos vagy rejtélyes módon., Így a CH3 és CH2 csoportok közötti kémiai eltolódási különbségeket a Hornback könyvében annak tulajdonítják, hogy” a szén valamivel elektronegatívabb, mint a hidrogén ” (Hornback, 2006, 549. o.) annak ellenére, hogy az alkilcsoportot korábban gyenge induktív elektron-donáló szubsztituensnek minősítették (Hornback, 2006, 117.o.). A Vollhardt-féle tankönyvben a metilcsoport kémiai eltolódása számos CH3X vegyület és az X Elektronegativitás kapcsolatát egy táblázat szemlélteti, amelyben nincs x=metil (Vollhardt & Schore,2014, p., 389), így elkerülve a kellemetlen szén-dioxid-problémát.
itt megmutatom, hogy az alkilcsoport a –i+r szubsztituensként viselkedik. Bár ebben a megközelítésben bizonyos tényezőket (mint például a mező, a szterin vagy az oldószer hatásait) implicit módon figyelmen kívül hagynak, sok jelenleg rendelkezésre álló elméleti és kísérleti bizonyíték így könnyen leírható.
a cδ — Hδ+ bond polarizációt kísérletileg megfigyelték a metán esetében (Lazzeretti, Zanasi, & Raynes, 1987), következetesen a szén hidrogénhez viszonyított nagyobb elektronegativitásával, 2.55 vs.2.,20 a Pauling-skálán (Allred, 1961). Egy ilyen polarizációs minta lehetővé teszi az egyszerű szénhidrogének dipól pillanatnyi irányának előrejelzését adalékanyag-modelleken keresztül, bár a mennyiségi megállapodás általában szerény (2-metil-propán: 0,3 d becsült vs.0,132 d kísérleti) (Dean, 1999).
mivel az Ingold szubsztituensek osztályozásában a hidrogént használják standardként (Krygowski & St??pień, 2005) az alkilcsoportot a –i szubsztituensnek (tehát σ elektron-kivonó csoportnak) kell besorolni. Ezt a szerepet az ábra szemlélteti., 1 A σ kötés polarizáció bármilyen atom Y egy metil-csoport, bár a fordított kötés polarizáció várható, ha Y egy elektronegatív, mint a szén (pl klór).
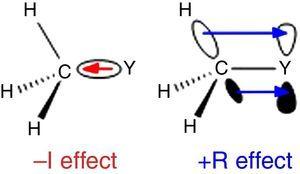
– i (balra) és +R (jobbra) az Y atomhoz kötött metilcsoport hatásai.
A különböző viselkedés az alkil csoportok, amikor csatolt sp2 vagy sp-keresztez atomok miatt elektron sűrűség adomány alkil-C–H C–C σ kötvények, hogy az üres p orbitális a szomszédos atom (a legegyszerűbb π-rendszer), az ábrán látható. 1. Így a fenol és benzoesav gázfázisú savasságának p-metil szubsztitúcióval történő csökkenése (McMahon & Kebarle, 1977) csak a metil-szubsztituens (valójában nagyobb, mint a metoxi-csoport) jelentős π-donor hatásának tulajdonítható., Az alkilcsoportot azonban atipikus π-donor szubsztituensnek kell tekinteni a magányos elektronpárok hiánya miatt. Ilyen egy σ-bond/π-rendszer kölcsönhatása, a neve, mint hyperconjugation (Mullins, 2012) könnyen magyarázható analógiájára a π-donor viselkedését egy magányos pár-csapágy atom (pl. klór), hogy egy üres p orbitális, bár a C–C, vagy C–H kötések (inkább, mint a magányos elektron pár), az alkil csoport vesz részt, mint elektron-felszabadító egység hyperconjugative kölcsönhatások., Érdekes módon π→σ* kölcsönhatások (negatív hiperkonjugáció) általában elhanyagolhatóak az elektronegatív atomokkal nem rendelkező alkilcsoportoknál (Bocca, Pontes, & Basso, 2004).
egyes molekuláris szerkezeti jellemzők ésszerűsíthetők az alkilcsoport tulajdonságai alapján. Például a metil-ketonokban (aceton: exp. 1.210 Å, calc. 1.193 Å) a kapcsolódó aldehidekkel (acetaldehid: exp. 1.209 Å, calc. 1.,188å) (Berry, Waltman, Pacansky, & Hagler, 1995)a zwitterionos rezonancia forma stabilizálásának tulajdonítható (Lásd az ábrát. 2) alkilcsoporton keresztül π-adomány a karbonsav szénatomhoz, ezáltal gyengítve a karbonilcsoport kettős kötési jellemzőjét.
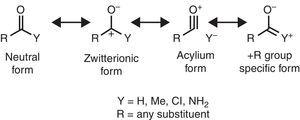
karbonilvegyület semleges (bal) és zwitterionos (jobb) rezonanciaformái.
Hyperconjugative kölcsönhatások függ a megállapodás a C–H (vagy a C–C) a kötvények viszonylagos, hogy a p orbitális a szomszédos atom Y, a hatékony interakció megfelelő majdnem párhuzamos elrendezés. Például a keretsíkra majdnem merőleges toluol Csp3–H kötés valamivel hosszabb, mint a többi Csp3–H kötés (0,002 Å, Hameka & Jensen, 1996)., A hiperkonjugáció geometriai függése lehetővé teszi a metil-szubsztituált telítetlen vegyületek, például a propén (Liberles, O ‘ Leary, Eilers, & Whitman, 1972) vagy acetaldehid (Muñoz-Caro, Niño, & Moule, 1994) konformációs elemzését.
az alkilcsoport π-donor viselkedésének jól ismert következményeként az alkil szubsztitúció több elektronban gazdag alként és arént eredményez (Libit & Hoffmann, 1974)., Az alkil-szubsztituált arén nagy reaktivitása egy SEAr reakcióban tehát a megfelelő Wheland közbenső stabilizálásának tulajdonítható π-elektron adomány útján.
az alkilcsoport-i + R viselkedése lehetővé teszi az alkil-szubsztituált vegyületek számos jellemzőjének magyarázatát, mint például a dipól pillanatok, a spektroszkópiai tulajdonságok és a reaktivitás (gázfázisban és oldatos közegben), az alábbiak szerint.
dipól pillanatok
az alkilcsoport elektronkivonó viselkedése az alifás vegyületekben a dipól pillanatokban is tükröződik., Így a propán és a 2-Metilpropán (Tasi et al., 1997), valamint néhány szubsztituált bicikloktan (Böhm & Exner, 2004) a metilcsoport kivonó hatásának (–i) tulajdonítható a hidrogénhez képest (lásd az ábrát. 3).
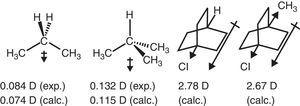
a propán és a szubsztituált bicikloktanok dipólus pillanatai.
ezzel szemben a metil-csoport (+r) π-donor karaktere szükséges a nitrobenzol és benzonitril p-metil-szubsztitúcióval (Brown, 1959) történő dipol-pillanatainak magyarázatához (lásd 1. 4).
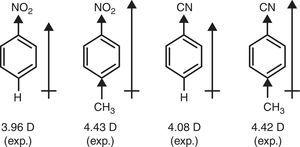
benzolszármazékok dipólus pillanatai.
a molekuláris dipól pillanatok megbízhatóan kiszámíthatók a jelenlegi számítási módszerekkel., Érdekes, hogy a számított dipól pillanat vektorok egy sor egyszerű szénhidrogének (Tasi et al., 1997) lehetővé tették a metil-csoport kettős szerepének következtetését: elektron-visszavonás, ha sp3 szénatomokhoz kapcsolódik, de elektron-adományozás, amikor sp2 vagy sp3 karbonokhoz van kötve.
az alkil-szubsztituens ilyen kettős viselkedését heteroatomot hordozó vegyületek esetében is megfigyeljük. Így fokozatos dipól pillanatcsökkenés figyelhető meg az ammónia egymást követő metil-helyettesítésére (NH3, 1,47 D; MeNH2, 1,31 D; Me2NH, 1,01 D; Me3N, 0.,61 D) (Le Fèvre &Russell, 1947), a nitrogén elektronsűrűség fokozatos csökkenésével egyetértésben (Hehre & Pople, 1970). Ezzel szemben egy dipólnyomaték javítása (a 1.53 D 1.68 D) (Nelson, Lide, & Maryott, 1967) az N,N-dimetil-helyettesítő a anilin (Targema, Obi-Egbedi, & Adeoye, 2013), következetesen az emeléssel a π-donor karakter az amino csoport (Hinchliffe & Kidd, 1980) miatt +R hozzájárulások a metil-substituents.,
Spektroszkópos tulajdonságok
számos szerves vegyület spektroszkópiai tulajdonságai könnyen ésszerűsíthetők, ha az alkilcsoportra általános jellemzőként a –I+R viselkedést feltételeznek. Így egy atom NMR kémiai eltolódása az elektron sűrűségének kísérleti mérésének tekinthető a megfelelő magpozícióban, bár más hatások – például anizotróp mágneses mezők – is szerepet játszhatnak. Az SP3 szénatomokon (+9,6 ppm 13C NMR-ben) vagy a megfelelő kötött hidrogénatomokon (+0.,63ppm 1H NMR-ben) (Pretsch, Bühlmann, & Badertscher, 2009) összhangban vannak a tipikus –i csoportok (például halogénatomok) viselkedésével.
Alkil-helyettesítő hatások a NMR kémiai műszakban az alkének show egy elektron sűrűség csökkenése α pozíció (+12.9 ppm 13C NMR; +0.45 ppm 1H NMR), valamint a sűrűség emelje fel a β pozíció (-7.4 ppm 13C; -0.31/-0.40 ppm 1H), következetesen egy –I+R hatást, bár anizotróp hatások (pl. gyűrű áramlatok) is szerepet játszanak. Az ilyen-i+r viselkedés az alkinok esetében is megtalálható, a 13C NMR spektroszkópia szerint (+8.,5 ppm α pozíció esetén, -3,6 ppm β pozíció esetén).
az alkil-szubsztituensek π-rendszereken (az α-atom elektronsűrűsége emelkedik, a β-atom elektronsűrűsége csökken) dikotóm viselkedése nem magyarázható egyszerű viselkedés (például a +i hatás) alapján.
A –i+R viselkedés (Meier, 2007) keresztül figyelhető meg 15N NMR spektroszkópia a alkil-helyettesítő a aminok, valamint amidok, attól függően, hogy a nitrogén-hibridizáció (a pályát műszakban, alifás aminok, a pályára műszakban, Nsp2-csapágy vegyületek, mint például anilines, valamint amidok).,
NMR kapcsolási állandók is függ szubsztituens elektronikus tulajdonságok (valamint néhány geometriai jellemzők). Így jelentősen csökkenne az 1H–1H csatolási állandók keresztül metil-helyettesítő (trans, -2.3 Hz; fák, -1.6 Hz; gem, -0.4 Hz-en), minőségi megállapodás adatok a tipikus elektron-visszavonja csoportok, mint például a fluor (trans, -6.3 Hz; fák, -6.9 Hz; gem, -5.7 Hz). A metil-szubsztitúció pozitív hozzájárulása az alifás vegyületek 13C-1H kapcsolási állandóin (+1.,0HZ), minőségileg összhangban van más –i csoportokkal (fluor, +24Hz).
Az infravörös spektroszkópia érzékeny a szubsztituens tulajdonságokra is, amint azt a karbonilvegyületek CO-stretching frekvenciája szemlélteti a megfelelő y szubsztituens függvényében, amely a rezonancia formák szempontjából ésszerűsíthető (ábra. 2). Alifás aldehid (kb., 1725cm-1) referenciaként az A +I szubsztituens (acetiltrimetilszilán, 1645cm–1: Soderquist & Hsu, 1982) által kiváltott redshift (hullámszámcsökkenés) a zwitterionikus forma stabilizálásának tulajdonítható. Ehelyett az A-I szubsztituens (Acil-kloridok, >1800cm–1: Pretsch et al., 2009) két alternatív vagy egyidejű mechanizmussal magyarázható (a zwitterionos forma destabilizálása és/vagy egy acylium ionhordozó forma hozzájárulása). Végül a + R szubsztituensek (amidok, kb., 1680cm–1: Pretsch et al., 2009) egy adott rezonancia forma hozzájárulásának tulajdonítható. Az alkilcsoport (metil-ketonok, kb. 1715cm-1) nettó elektron-adományozó hatást mutat (tehát a +R hatás túlsúlya az I-nél). A nettó donor hatása a karbonil-köteles alkil csoport összhangban van a nagyobb dipólnyomaték aceton (2.88 D) viszonyítva formaldehid (2.33 D) (Nelson et al., 1967).
az alkilcsoport hatása számos vegyület UV–Vis spektrumára az elektronikus hatások szempontjából is magyarázható., Így az alkilcsoportok által az α,β-telítetlen vegyületek (+10nm α helyzetben, +12nm β helyzetben), konjugált poliének (+5nm) vagy benzolszármazékok (+3,0 nm) UV abszorpciós sávjain indukált bathokróm eltolódások minőségi szempontból összhangban vannak a tipikus π-donor csoportok (pl. klór) hatásaival.
gázfázisú sav-bázis reaktivitás
az alifás aminok relatív bázispontjait vizes oldatban az alkilcsoport feltételezett +I hatásának tulajdonították (Sorrell, 2006)., Interestingly, the irregular basicity order of amines in water (Me2NH>MeNH2>Me3N>NH3, as shown by the pKa values for the corresponding conjugated acids: 10.77>10.62>9.80>9.,246) (Dean, 1999) oldószerhatásokkal szennyezett, amint azt a gázfázisban lévő aminok szisztematikus alapossági sorrendje szemlélteti (Me3N>Me2NH>MeNH2>NH3) (Brauman, Riveros, & Blair, 1971)., Bár a gázfázisú bázikusság sorrendje az általában feltételezett +I alkilhatásnak tulajdonítható (Carter, 2007), a nitrogén elektron sűrűségének csökkenését metil –szubsztitúció révén valóban megfigyelték molekuláris elektrosztatikus potenciál számítások (Baeten, de Proft, & Geerlings, 1995), így jelezve a-i viselkedést a metilcsoportra., Valójában az alifás aminok gázfázisú bázikus sorrendjét a szubsztituált ammóniumionok növekvő stabilizációjának kell tulajdonítani az alkilcsoport polarizálhatósága miatt (Aue, Webb, & Bowers, 1976).
az alkoholok relatív savtartalma vizes oldatban (H2O>MeOH>EtOH>iPrOH>tbuoh) egyes tankönyvekben a feltételezett alkil +I-effektusnak tulajdonították (Johnson, 1999; Solomons, fryhle,& Snyder, 2016)., Mivel a fordított savassági sorrend a gázfázisban található, a vízben lévő alkoholok relatív savtartalmát a nagyobb alkoxid anionok szolvációs entalpiáinak alacsonyabb nagyságainak kell tulajdonítani (Brauman & Blair, 1969).
az alkilcsoport elektronikus tulajdonságairól szóló vita a karbanionokra is alkalmazható. Így az egyszerű karbanionok”tankönyv”stabilitási sorrendjét (metil>etil>izopropil>terc-butil) az alkilcsoportok (Burrows et al.,, 2013; Chaloner, 2015; Roos & Roos, 2014; Smith, 2013). A gázfázisú karbanion stabilitásokra azonban szabálytalan sorrendet találunk (TBU>Me >iPrEt), két ellentétes alkilhatás (DePuy et al., 1989): egy stabilizáló mechanizmus alkil-polarizálhatóság (azaz n→σ* hiperkonjugáció) és egy destabilizáló trend (következetesen a +R szereppel, p-szerű viselkedés feltételezésével a szén-magányos pár számára).,
más reakcióköztiterek stabilitása alkilcsoporthatások alapján is értékelhető. Így a karbokációk jól ismert stabilitási sorrendjét (tercier>másodlagos>primer>metil) néha pozitív induktív hatásnak tulajdonították (Chaloner, 2015; Roos & Roos, 2014)., Érdekes, hogy a hiperkonjugáció számos tankönyvben alternatív magyarázatként jelenik meg a karbocációk stabilitási sorrendjének (Brown, Iverson, Anslyn, & Foote, 2013; Burrows et al., 2013) bár a szokásos kétértelmű írás megakadályozza annak megállapítását, hogy mindkét magyarázat megfelel-e ugyanazon jelenség két különböző leírásának vagy két párhuzamos mechanizmusnak, amelyek ugyanabban az irányban játszanak., Mindenesetre a karbokációk stabilitási sorrendjét a hiperkonjugációnak kell tulajdonítani (tehát a + R viselkedés egy üres p orbitális, a legegyszerűbb π rendszer), bár más kölcsönhatások (például alkil-polarizabilitás) is részt vesznek (Aue, 2011).
a szabad gyökök ugyanolyan stabilitási sorrendet mutatnak, mint a karbokációk, így az alkil helyettesítéssel történő stabilizációt jelzik. Bár egy ilyen stabilitási sorrend egy feltételezett +I viselkedés alapján igazolható, a +R hatás alternatívaként tekinthető, hasonlóan a szabad gyökök stabilizálásához magányos párhordozó atomokkal (Zipse, 2006).,
reaktivitás oldatban
az egyszerű karbonsavak relatív savasságát vizes oldatban (ecetsav>propionsav> butirinsav) használták néhány tankönyvben az alkilcsoport feltételezett +I hatásának szemléltetésére (Sorrell, 2006). Érdekes módon a fordított sorrend akkor fordul elő, amikor az entalpiákat ehelyett tekintik (Christensen, Izatt, & Hansen, 1967), így jelezve, hogy a vizes oldatban a savassági sorrendet a hidratációs entrópiáknak kell tulajdonítani., Így a jelentős rácsos sorrendben folyékony víz (párologtatás entrópia egyenlő 118,89 Jmol-1K-1, ellentétben a tipikus értékei ca. 88Jmol–1k-1 A legtöbb folyadék esetében, Dean, 1999) jelentős változásokat vezethet be a reakció energetikáján. Különösen az apoláris molekulák (vagy mozik) hidratálása további oldószerrácsrendezéshez vezet (Blokzijl & Engberts, 1993). Ennek következtében a vizes oldatban végzett kísérleti adatokból származó alkilcsoport induktív hatásait gyakran hidratációs entrópiák maszkolják (Calder & Barton, 1971)., Egyszerű karbonsavak relatív savai gázfázisban (Yamdagni & Kebarle, 1973) és acetonitril (Eckert et al., 2009) összhangban vannak a hidratációs entrópiák fő szerepével.
a pivalinsav alacsonyabb savassága az ecetsavhoz képest, amelyet általában az alkilcsoport feltételezett +I hatásának tulajdonítanak (Smith, 2008), megfordul, amikor a reakció-entalpiákat figyelembe veszik (Eckert et al., 2009).,
a vizes oldatban az egyszerű karbonsavak savasságára gyakorolt feltételezett +I alkilcsoport-hatás tehát az oldószerhatásokból származó tárgynak tulajdonítható. Míg a semleges oldatok térfogatnövekedése hidratációs entrópia emelkedéshez vezet, az ionos fajok esetében fordított kapcsolat található (Graziano, 2009). Ennek következtében az alkil szubsztitúció (a molekuláris térfogat növelésével) a vízben nem ionizált sav stabilizálásához (Gibbs szabad energia szempontjából), valamint a megfelelő karboxilát anion destabilizációjához vezet, így savasságcsökkenést eredményez.,
A nagyobb savtartalma hangyasav képest ecetsav vizes oldatban (pKa értékei: 3.751, valamint 4.756, illetve Dean, 1999) is tárgyalt a sok tankönyvek is, mint például az alkalmazás az indukciós hatások (Hart, Hadad, Craine, & Hart, 2012; Hornback, 2006; Okuyama & Maskill, 2014; Roos & Roos, 2014). Mivel a hangyasavak és ecetsavak disszociációs reakcióiban nagyon hasonló reakció entalpiák vesznek részt (Christensen et al.,, 1967), a hangyasav nagyobb savasságát valóban a hidratációs entrópia különbségeinek kell tulajdonítani.
következtetések
az induktív és rezonancia hatások egyértelmű megértése a Szerves Kémia hangos tanulásának fő kulcsa (Mullins, 2008). Meglepő módon a szinte mindenütt jelenlévő alkilcsoportot számos tankönyvben helytelenül mutatták be σ-donor (+I) csoportként. A kettős viselkedést azonban alkil-szubsztituensek mutatják a szomszéd atom hibridizációjától függően., Így az alifás láncokhoz kötött alkilcsoportok σ-akceptorokként viselkednek (–I, következetesen a hidrogénhez viszonyított szén nagyobb elektronegativitásával), míg a π-rendszerekhez kapcsolódók π-donorokként (+r, hiperkonjugatív kölcsönhatások miatt) működnek. Számos kísérleti és elméleti adat (dipóluspercek, NMR, IR és UV spektrumok, reaktivitás) ért egyet egy ilyen kettős viselkedéssel.,
az itt vizsgált összes adat teljes elemzése lehetővé teszi egy kis –I hatás, valamint az alkilcsoport szignifikáns +r viselkedésének következtetését, mint a szerves vegyületek spektroszkópiai és reaktivitási tulajdonságairól folytatott minden megbeszélésben érvényes tulajdonságot.
összeférhetetlenség
a szerző nem nyilvánít összeférhetetlenséget.