Johdanto
Substituentin vaikutukset ovat keskeinen käsite ymmärtäminen reaktiivisuus ja spektroskooppiset käyttäytymistä orgaanisten yhdisteiden (Krygowski & St??pień, 2005). Yksinkertainen lähestymistapa, substituentin vaikutuksia voidaan luokitella sen mukaan, mekanismi vuorovaikutus reaktiivinen keskus induktiivinen (kautta σ-sidoksia) tai resonanssi vaikutuksia (kautta g-joukkolainat)., Kuitenkin, joitakin muita ehtoja (kuten steric, kenttä tai liuottimen vaikutukset), tarvittaisiin perusteellinen kuvaus substituentin vaikutuksia.
Koska Ingold on luokittelu sähköisen substituentin vaikutuksia (Ingold, 1953), että alkyyli-ryhmä on pidetty σ-luovuttajan substituentin (+I Ingold nimikkeistön mukaisesti) useimmissa Orgaanisen Kemian oppikirjoja (Burrows, Holman, Parsons, Pilling, & Hinta, 2013; Hornback, 2006; Roos & Roos, 2014; Smith, 2013; Vollhardt & Schore, 2014)., Kuitenkin Eğe on kritiikkiä niin yksinkertainen näkökulmasta pitäisi olla huomautti:
”vedessä, propaanihappo on hieman heikompi kuin etikkahappoa. Kemistit väittelevät alkyyliryhmän induktiivisen vaikutuksen luonteesta. Alkyyliryhmät stabiloivat karbokationeja ja siinä roolissa ne näyttävät olevan elektroneja vapauttavia. Ne myös lisäävät amiinien basisiteettia, mikä taas viittaa siihen, että ne vapauttavat elektroneja. Toisaalta vaikka tert-butyylialkoholi (pKa 19) on vedessä etanolia (pKa 17) heikompi happo, se on kaasufaasissa vahvempi happo., Tämä kokeellinen havainto viittaa siihen, kuin alkyyli-ryhmät voivat vakauttaa anionit sekä kationeja ja että liuotuksessa on tärkeä rooli määritettäessä suhteellinen acidities. Siksi tarvitaan varoituksen sana. Suhteelliset hapot, joihin tässä luvussa esitetyt yleistykset perustuvat, määritettiin vedessä. Kaasufaasissa nähdään usein toisiinsa liittyvien yhdisteiden järjestyksessä tapahtuvia peruutuksia.”(Eğe, 1999, s. 107)
Jotkut alkyyli korvaaminen vaikutukset ovat olleet usein selitetään oppikirjoissa ristiriitaisia tai arvoituksellinen tavoin., Näin ollen kemiallisen siirtymän eroja CH3-ja CH2-ryhmien johtuvan vuonna Hornback on kirja siitä, että ”hiili on hieman enemmän electronegative kuin vety” (Hornback, 2006, s. 549), vaikka alkyyli-ryhmä on aiemmin luokiteltu heikko induktiivinen electron-lahjoittamalla substituentin (Hornback, 2006, s. 117). Vuonna Vollhardt on oppikirja, suhde metyyli-ryhmä kemialliset siirtymät useita CH3X yhdisteitä ja X-elektronegatiivisuus on havainnollistettu taulukon puuttuu merkintä X=metyyli (Vollhardt & Schore, 2014, s., 389), jolloin vältetään hankalaa hiilikysymystä.
näytän tässä, että alkyyliryhmä käyttäytyy a –I+R-substituenttina. Vaikka jotkin tekijät (kuten kenttä -, steris-tai liuotinvaikutukset) sivuutetaan implisiittisesti tässä lähestymistavassa, monia tällä hetkellä saatavilla olevia teoreettisia ja kokeellisia todisteita voidaan siten kuvata helpolla tavalla.
Cδ–Hδ+ bond polarisaatio on kokeellisesti havaittu metaani (Lazzeretti, Zanasi, & Raynes, 1987), johdonmukaisesti suurempi elektronegatiivisuus hiiltä suhteessa vetyyn, 2.55 vs. 2.,20 Paulingin asteikolla (Allred, 1961). Tällainen polarisaatio kuvio mahdollistaa ennustaa dipoli hetki suuntaan yksinkertaisia hiilivetyjä kautta additiivisia malleja, vaikka määrälliset sopimus on yleensä vaatimaton (2-metyylipropaani: 0.3 D arvioitu vs. 0.132 D kokeellinen) (Dean, 1999).
Koska vetyä käytetään standardin Ingold on luokittelu substituentteja (Krygowski & St??pień, 2005), alkyyli-ryhmä luokitellaan a –I substituentin (siis σ-electron-ryhmän vetäminen). Tällainen rooli on kuvitettu viikunalla., 1 σ-sidos polarisaatio mistä tahansa atom-Y-metyyli-ryhmä, vaikka reverse side polarisaatio on odotettavissa, kun Y on enemmän electronegative kuin hiilidioksidin (esim. klooria).
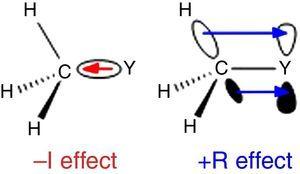
–i (vasemmalla) ja +R (oikealla) atomiin Y.
erilainen käyttäytyminen on löytynyt alkyyliryhmiä, kun liitetty sp2 tai sp-hybridisoitiin atomien koska elektroni tiheys lahjoitus alkyyli-C–H-tai C–C σ joukkovelkakirjojen tyhjä p kiertoradan vierekkäin atom (yksinkertaisin d-järjestelmä), kuten on esitetty Kuviossa. 1. Näin ollen, vähentää kaasun vaihe happamuus fenoli ja bentsoehappo kautta p-metyyli korvaaminen (McMahon & Kebarle, 1977) voidaan katsoa merkittävä d-luovuttajan vaikutus metyyli-substituentin (itse asiassa suurempi kuin metoksi-ryhmä)., Alkyyliryhmää on kuitenkin pidettävä epätyypillisenä π-luovuttajan substituenttina, koska yksinäisiä elektronipareja ei ole. Tällainen σ-sidos/d-järjestelmä vuorovaikutus, nimettiin hyperconjugation (Mullins, 2012) voi helposti selittää analogisesti d-luovuttajan käyttäytymistä lone-pair-laakeri atom (esim. klooria) tyhjä p kiertoradan, vaikka C–C tai C–H joukkovelkakirjojen (pikemminkin kuin electron yksinäinen paria) alkyyli-ryhmä ovat mukana electron-vapauttaa yksiköiden hyperconjugative vuorovaikutusta., Mielenkiintoista, π→σ* interaktio (negatiivinen hyperconjugation) ovat yleensä hyvin vähäinen alkyyli ryhmien puuttuu electronegative atomeja (Bocca, Pontes, & Basso, 2004).
jotkut molekyylirakenteiset ominaisuudet voidaan rationalisoida alkyyliryhmän ominaisuuksien perusteella. Esimerkiksi metyyliketoneista (asetoni: exp. 1.210 Å, calc. 1.193 Å) verrattuna niihin liittyviin aldehydeihin (asetaldehydi: exp. 1.209 Å, calc. 1.,188Å) (Marja, Waltman, Pacansky, & Hagler, 1995) voidaan katsoa vakauttaminen zwitterionic resonanssi muodossa (ks. 2) kautta alkyyliryhmä π-lahjoitus karbonyylihiiliatomille, mikä heikentää karbonyyliryhmän kaksoissidosominaisuutta.
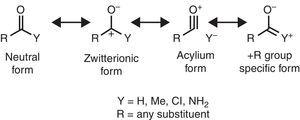
karbonyyliyhdisteen neutraalit (vasen) ja zwitterioniset (oikea) resonanssimuodot.
Hyperconjugative vuorovaikutukset ovat riippuvaisia järjestely C–H (tai C–C) joukkovelkakirjojen suhteellinen p kiertoradan vierekkäin atom Y, tehokkain vuorovaikutus, joka vastaa lähes rinnakkain järjestely. Esimerkiksi tolueeni Csp3–H-sidoksen lähes kohtisuorassa framework kone on hieman pidempi kuin muut Csp3–H joukkovelkakirjojen (0.002 Å, Hameka & Jensen, 1996)., Geometria riippuvuus hyperconjugation avulla selittää conformational analyysi metyyli-substituoitu tyydyttymättömiä yhdisteitä, kuten propeeni (Liberles, O ’ leary, Eilers, & Whitman, 1972) tai asetaldehydiä (Muñoz-Caro, Niño, & Moule, 1994).
tunnettu seuraus d-luovuttajan käyttäytymistä alkyyli-ryhmä, alkyyli korvaaminen tuottaa enemmän elektroni-rikas alkeenit ja arenes (Libit & Hoffmann, 1974)., Korkea reaktiivisuus alkyyli-substituoidut arene on Ruskistaa reaktio voi siten johtua vakauttaminen vastaava Wheland väli kautta π-elektroni lahjoitus.
–I+R käyttäytymistä alkyyli ryhmän avulla selittää useita piirteitä alkyyli-substituoidut yhdisteet, kuten dipoli hetkiä, spektroskooppiset ominaisuudet ja reaktiivisuus (kaasu-vaihe ja ratkaisu media), kuten alla.
Dipoli hetkiä
electron-peruuttamista käyttäytymistä alkyyli ryhmän alifaattisia yhdisteitä heijastuu myös dipoli hetkiä., Näin ollen propaanin ja 2-metyylipropaanin (Tasi et al., 1997), sekä joitakin korvata bicyclooctanes (Böhm & Exner, 2004) voidaan katsoa eroavan vaikutus (–I) ja metyyli-ryhmä verrattuna vety (ks. 3).
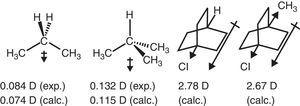
propaanin ja korvaavien bikyklo-oktaanien dipolimomentit.
sen sijaan d-luovuttaja luonne metyyli-ryhmä (+R) tarvitaan, jotta voidaan selittää nostaa dipoli hetkiä nitrobentseeni ja benzonitrile kautta p-metyyli korvaaminen (Ruskea, 1959) (ks. 4).
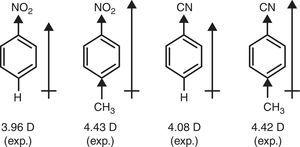
bentseenijohdannaisten dipolimomentit.
Molekyyli-dipoli hetkiä voidaan luotettavasti laskea nykyinen laskennallisia menetelmiä., Mielenkiintoista on, että lasketaan dipolimomenttivektorit joukolle yksinkertaisia hiilivetyjä (Tasi et al., 1997) on voitu päätellä, dual rooli metyyli-ryhmä: electron-peruuttaa, kun se on liitetty sp3 hiiliatomia, mutta electron-lahjoittamalla kun pakko sp2 tai sp3 hiilivetyjä.
tällainen alkyylisubstituentin kaksikäyttäytyminen on havaittavissa myös heteroatomia kantavilla yhdisteillä. Siten asteittainen dipoli hetki lasku on havaittu peräkkäisten metyyli korvaaminen ammoniakin (NH3, 1.47 D; MeNH2, 1.31 D; Me2NH, 1.01 D; Me3N, 0.,61 D) (Le Fèvre & Russell, 1947), kanssa asteittainen väheneminen typen electron tiheys (Hehre & Pople, 1970). Sen sijaan, dipoli hetki lisälaite (alkaen 1.53 D 1.68 D) (Nelson, Lide, & Maryott, 1967) on löytynyt N,N-dimetyyli korvaaminen aniliini (Targema, Obi-Egbedi, & Adeoye, 2013), johdonmukaisesti nostaa d-luovuttajan merkin aminoryhmä (Hinchliffe & Kidd, 1980) takia +R maksut metyyli substituentteja.,
Spektroskooppiset ominaisuudet
Spektroskooppiset ominaisuudet, monet orgaaniset yhdisteet, jotka voidaan helposti perustella olettamalla, a –I+R käyttäytymistä alkyyli ryhmän yleinen ominaisuus. Näin ollen NMR kemialliset siirtyminen atomin voidaan pitää kokeellisena mitta electron tiheys vastaava ydin kantaa, vaikka muut vaikutukset – kuten anisotrooppinen magneetti-aloilla, voi myös olla mukana. Hän siirtyy aiheuttama metyyli-substituentin paikan sp3 hiiliatomia (+9.6 ppm 13 C NMR) tai vastaava sitoutuneet vetyatomit (+0.,63ppm 1H NMR) (Pretsch, Bühlmann, & Badertscher, 2009) ovat yhdenmukaisia käyttäytymistä tyypillinen –ryhmät (kuten halogeeniatomeja).
– Alkyyli korvaaminen vaikutuksia NMR kemialliset siirtymät alkeenit ssa elektroni tiheys lasku α kanta (+12.9 ppm 13 C NMR; +0.45 ppm 1H NMR), sekä tiheys nostaa β-asentoon (-7.4 ppm 13 C; -0.31/-0.40 ppm 1H), johdonmukaisesti a –I+R vaikutus, vaikka anisotrooppinen vaikutuksia (kuten rengas virtaukset) voi myös olla tärkeä rooli. Tällainen A-I+R-käyttäytyminen löytyy myös alkyyneille 13C NMR-spektroskopian (+8.,5ppm α-asennossa, -3,6 ppm β-asennossa).
dikotominen käyttäytymistä alkyyli-substituentit on π-järjestelmät (electron tiheys nostaa α atomi, elektroni tiheys laskea β atom) ei voida selittää perusteella yksinkertainen käytös (kuten +I vaikutus).
A –I+R käyttäytymistä (Meier, 2007) on havaittu kautta 15N NMR-spektroskopia varten alkyyli korvaaminen amiinit ja amidit riippuen typen hybridisaatio (alaspäin työvuorojen alifaattiset amiinit, upfield työvuorojen Nsp2-laakeri yhdisteet – kuten anilines ja amidit).,
NMR-kytkentävakiot ovat myös riippuvaisia substituenteista elektronisista ominaisuuksista (sekä joistakin geometrisista ominaisuuksista). Näin merkittävä aleneminen on löytynyt 1H–1H kytkentä vakiot kautta metyyli korvaaminen (trans, -2.3 Hz; ivy, -1.6 Hz; gem, -0.4 Hz), laadullinen sopimus kanssa tiedot alkaen tyypillinen elektroni-vetää ryhmiä, kuten fluoriatomi (trans, muutos -6,3 Hz; ivy, -6.9 Hz; gem, -5.7 Hz). Metyyli-substituution positiivinen vaikutus alifaattisten yhdisteiden 13C–1h-kytkentävakioihin (+1.,0Hz), on myös laadullisesti yhdenmukainen muiden-I-ryhmien (fluori, +24Hz) kanssa.
Infrapuna spektroskopia on myös herkkä substituentin ominaisuuksia, kuten osoituksena CO venyttely taajuus karbonyyli-yhdisteiden funktiona vastaava substituentin Y, joka voidaan rationalisoida kannalta resonanssi muotoja (Kuva. 2). Ottamalla alifaattisen aldehydin(n., 1725cm–1) referenssinä, punasiirtymä (wavenumber lasku) aiheuttama +I substituentin (acetyltrimethylsilane, 1645cm–1: Soderquist & Hsu, 1982) voidaan katsoa vakauttaminen zwitterionic muodossa. Sen sijaan, blueshift aiheuttama a –I substituentin (asyyli kloridit, >1800cm–1: Pretsch et al., 2009) voidaan selittää kahdella vaihtoehtoisia tai samanaikaisesti mekanismeja (epävakautta zwitterionic muodossa ja/tai panos on acylium ion-laakeri lomake). Lopuksi, redshifts provosoi +R substituentteja (amidit, ca., 1680cm-1: Pretsch ym., 2009) voidaan katsoa johtuvan tietyn resonanssimuodon vaikutuksesta. Alkyyliryhmän aiheuttama lievä punasiirtymä (metyyliketonit, n. 1715cm-1) osoittaa nettoelektronilahjoitusvaikutuksen (eli +R –efektin yli-i-ominaisuuksien hallitsevuuden). Net luovuttajan vaikutus karbonyyli-sidottu alkyyli-ryhmä on sopusoinnussa suurempi dipoli hetki asetoni (2.88 D) suhteessa formaldehydi (2.33 D) (Nelson et al., 1967).
alkyyliryhmän vaikutus monien yhdisteiden UV–Vis-spektriin voidaan selittää myös elektronisilla vaikutuksilla., Näin ollen bathochromic työvuorojen aiheuttama alkyyli ryhmien UV-absorptio bändejä α,β-tyydyttymättömiä yhdisteitä (+10nm vuonna α-asennossa, +12nm vuonna β-asennossa), konjugoitu polyeenit (+5nm) tai bentseenin johdannaiset (+3,0 nm) ovat laadullisesti yhdenmukaisia vaikutukset tyypillinen d-luovuttajan ryhmät (esim. klooria).
kaasufaasin happo–emäsreaktioiden
alifaattisten amiinien suhteelliset emäkset vesiliuoksessa ovat johtuneet alkyyliryhmän oletetusta +I-vaikutuksesta (Sorrell, 2006)., Interestingly, the irregular basicity order of amines in water (Me2NH>MeNH2>Me3N>NH3, as shown by the pKa values for the corresponding conjugated acids: 10.77>10.62>9.80>9.,246) (Dean, 1999) on saastunut liuottimilla vaikutuksia, mistä on osoituksena järjestelmällisestä emäksisyys jotta amiineja kaasu-vaihe (Me3N>Me2NH>MeNH2>NH3) (Brauman, Riveros, & Blair, 1971)., Vaikka kaasun vaihe emäksisyys, jotta voidaan katsoa yleensä oletetaan +I alkyyli vaikutus (Carter, 2007), laskua typen electron tiheys kautta metyyli korvaaminen on ollut todellakin havaittu avulla Molekyyli Sähköstaattinen Potentiaali laskelmat (Baeten, De Proft, & Geerlings, 1995), mikä osoittaa a –I käyttäytymistä metyyli-ryhmä., Itse asiassa, kaasu vaihe emäksisyys jotta alifaattisten amiinien on kohdennettava yhä vakauttaminen korvata ammonium-ioneja, koska alkyyli-ryhmä polarizability (Aue, Webb, & Bowers, 1976).
Suhteellinen acidities alkoholit vesiliuos (H2O>MeOH>EtOH>iPrOH>tBuOH) on myös annettu joitakin oppikirjat oletettu alkyyli +I vaikutus (Johnson, 1999; Solomons, Fryhle, & Snyder, 2016)., Koska käänteinen happamuus, jotta ei löydy kaasun vaihe, suhteellinen acidities alkoholit veden pitäisi olla johtuvan alemman suuruudet liuotuksessa enthalpies suurempia alkoxide anionit (Brauman & Blair, 1969).
keskustelua alkyyliryhmän elektronisista ominaisuuksista voidaan soveltaa myös karbanioneihin. Näin ollen ’oppikirja’ vakaus, jotta yksinkertainen carbanions (metyyli>etyyli>isopropyyli>tert-butyyli -) on sanottu johtuvan oletettu +I induktiivinen vaikutus alkyyli-ryhmät (Burrows et al.,, 2013; Chaloner, 2015; Roos & Roos, 2014; Smith, 2013). Kuitenkin, epäsäännöllinen järjestys on löytynyt kaasun vaihe carbanion stabiiliudet (tBu>Minua>teollis-ja tekijänoikeuksien>Et) suostumuksella suostumuksella kaksi vastusti alkyyli vaikutuksia (Dcpuy et al., 1989): vakauttava mekanismi, alkyyli polarizability (eli n→σ* hyperconjugation) ja epävakautta trendi (johdonmukaisesti a +R tehtävä, jonka oletetaan, että p-käyttäytymistä hiilen yksinäinen pari).,
muiden reaktiovälittäjien stabiilisuutta voidaan arvioida myös alkyyliryhmän vaikutusten perusteella. Näin ollen tunnettuja vakautta, jotta carbocations (korkea-asteen>toissijainen>ensisijainen>metyyli) on ollut joskus johtuvan positiivinen induktiivinen vaikutus (Chaloner, 2015; Roos & Roos, 2014)., Mielenkiintoista, hyperconjugation on esitetty monia oppikirjoja kuin vaihtoehtoinen selitys vakautta, jotta carbocations (Ruskea, Iverson, Anslyn, & Foote, 2013; Burrows et al., 2013), vaikka tavallista epäselvä kirjoittaminen estää varmistua, että molemmat selitykset vastaavat joko kaksi erilaisia kuvauksia samasta ilmiöstä tai kaksi samanaikaista mekanismit pelaa samaan suuntaan., Joka tapauksessa, vakaus, jotta carbocations pitäisi johtua hyperconjugation (siis a+R käytös vapautunut p kiertoradan, yksinkertaisin d-järjestelmä), vaikka muut yhteisvaikutukset (kuten alkyyli-polarizability) ovat myös mukana (Aue, 2011).
vapaiden radikaalien stabiliteettijärjestys on sama kuin karbokationien, mikä viittaa vakautumiseen alkyylisubstituutiolla. Vaikka tällainen vakaus, jotta voidaan perustella oletettu +I käyttäytymistä, +R vaikutus voidaan vaihtoehtoisesti pitää, vastaavasti vakauttaminen vapaita radikaaleja lone-pair-laakeri atomien (Zipse, 2006).,
Reaktiivisuus ratkaisu
Suhteellinen acidities yksinkertainen karboksyylihapot vesiliuoksessa (etikkahappo>propionihappo>voihappo) on käytetty joissakin oppikirjoja havainnollistamiseksi oletetaan +I vaikutus alkyyli-ryhmä (Sorrell, 2006). Mielenkiintoista on, että päinvastaisessa järjestyksessä on löytynyt, kun enthalpies ovat sen sijaan pitää (Christensen, Izatt, & Hansen, 1967), mikä osoittaa, että happamuus jotta vesiliuoksessa pitäisi johtua nesteytys entropies., Näin ollen merkittävä ristikko jotta nestemäisen veden (höyrystyminen entropia eli 118.89 Jmol–1K–1, toisin tyypillisiä arvoja, ca. 88jmol-1K-1 useimmille nesteille, Dean, 1999) voi tuoda merkittäviä muutoksia reaktioenergetiikkaan. Erityisesti nesteytys vähentää korioamnioniitin sekä vastasyntyneen molekyylejä (tai moieties) johtaa edelleen liuotin ristikko tilaus (Blokzijl & Engberts, 1993). Seurauksena, alkyyli-ryhmä induktiivinen vaikutukset kokeelliset tiedot vesiliuoksessa ovat usein naamioitu nesteytys entropies (Calder & Barton, 1971)., Suhteellinen acidities yksinkertainen karboksyylihapot kaasu-vaihe (Yamdagni & Kebarle, 1973) ja asetonitriili (Eckert ym., 2009) ovat yhdenmukaisia nesteytys-entropioiden keskeisen roolin kanssa.
alempi happamuus pivalic happo verrattuna etikkahappoa, yleensä johtuu oletettu +I vaikutus alkyyli-ryhmä (Smith, 2008), on päinvastainen, kun reaktio enthalpies pidetään (Eckert ym., 2009).,
oletettu +I alkyyli ryhmän vaikutus happamuus yksinkertainen karboksyylihapot vesiliuoksessa voi siis johtua esine peräisin liuotin vaikutuksia. Ottaa huomioon, että tilavuus kasvaa neutraalin aineen johtaa nesteytys entropia nostaa, käänteinen suhde on löytynyt ionic lajeja (Graziano, 2009). Seurauksena, alkyyli korvaaminen (kautta kasvua molekyylien määrä) johtaa vakauttaminen (vuonna Gibbsin vapaa energia mitattuna) ei-ionisoitunut happo veteen sekä epävakautta vastaava karboksylaatti anioni, jolloin happamuus vähenee.,
suurempi happamuus muurahaishappoon verrattuna etikkahapon vesiliuos (pKa-arvot: 3.751 ja 4.756, vastaavasti, Dean, 1999) on myös keskusteltu monissa oppikirjoissa esimerkkinä soveltamisesta induktiivinen vaikutuksia (Hart, tuli Hadad, Craine, & Hart, 2012; Hornback, 2006; Okuyama & Maskill, 2014; Roos & Roos, 2014). Koska hyvin samankaltainen reaktio enthalpies ovat mukana dissosiaatio reaktioita muurahais-ja etikkahappoa (Christensen et al.,, 1967), suurempi happamuus muurahaishappo on todellakin johtuvan nesteytys entropia eroja.
päätelmät
induktiivisten ja resonanssivaikutusten selkeä ymmärtäminen on keskeinen tekijä orgaanisen kemian terveessä oppimisessa (Mullins, 2008). Yllättäen lähes kaikkialla läsnä oleva alkyyliryhmä on esitetty monissa oppikirjoissa virheellisesti σ-luovuttajaryhmänä (+I). Kaksikäytöksisyys näkyy kuitenkin alkyylisubstituenteilla riippuen naapuriatomin hybridisoitumisesta., Näin, alkyyli-ryhmät pakko alifaattiset ketjut käyttäytyä kuin σ-hyväksyvien (–en, johdonmukaisesti suurempi elektronegatiivisuus hiiltä suhteessa vetyyn), ottaa huomioon, että ne on kiinnitetty d-järjestelmät toimivat d-rahoittajien (+R, koska hyperconjugative vuorovaikutus). Useat kokeelliset ja teoreettiset tiedot (dipolimomentit, NMR, IR ja UV spectra, reaktiivisuus) ovat yhtä mieltä tällaisesta kaksikäyttäytymisestä.,
koko analyysi kaikki tiedot pidetään täällä avulla päättelemällä pieni –I vaikutus sekä merkittävä +R käyttäytymistä alkyyli ryhmän ominaisuus on voimassa kaikissa keskusteluissa spektroskooppiset ja reaktiivisuus ominaisuuksia orgaanisia yhdisteitä.
eturistiriita
kirjoittaja ei ilmoita eturistiriitoja.