La estructura de Lewis de la molécula de agua contiene dos enlaces simples alrededor del átomo de oxígeno. el número total de electrones de Valencia de los átomos de oxígeno e hidrógeno se utiliza para dibujar la estructura de lewis. Cada paso del dibujo de la estructura de lewis de H2O se explica en este tutorial.
H2O lewis structure
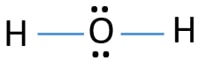
en la estructura de lewis de H2O, hay dos enlaces simples alrededor del átomo de oxígeno. Los átomos de hidrógeno están unidos al átomo de oxígeno a través de enlaces simples. Además, hay dos pares solitarios en el átomo de oxígeno.,
la molécula de agua es una molécula simple. El dibujo de la estructura de lewis de la molécula de agua es simple que algunas de otras moléculas o iones complejos. Imagine dibujar la estructura de lewis del ion tiosulfato.
pasos para dibujar la estructura de lewis de H2O
hay algunos pasos a seguir para dibujar una estructura de lewis correctamente. Para la molécula de H2O, su estructura de lewis y esos pasos se explican en detalle en este tutorial. Debido a que la molécula de agua es simple, algunos de estos pasos no se utilizan mucho. En tales casos, se mencionan con los pasos respectivos.,
- encontrar el número total de electrones de las capas de valance de átomos de hidrógeno y átomo de oxígeno
- pares Totales de electrones como pares y enlaces solitarios
- Selección de átomos de Centro
- marcar pares solitarios en átomos
- marcar cargas en átomos si las hay.
- Compruebe la estabilidad y minimice las cargas en los átomos convirtiendo pares solitarios en enlaces para obtener la mejor estructura de lewis.
importante: dibujar correctamente la estructura de lewis es importante para dibujar correctamente las estructuras de resonancia.,
el número Total de electrones de la cenefa conchas de H2O
Hay dos elementos, hidrógeno y oxígeno. El hidrógeno es un elemento del grupo IA y tiene solo un electrón en su última capa (capa de Valencia). El oxígeno es un grupo vía elemento en la Tabla periódica y contiene seis electrones en su última capa. Ahora sabemos cuántos electrones están incluidos en las capas de Valencia de cada átomo.,
- electrones de Valencia dados por átomos de hidrógeno = 1 * 2 = 2
- electrones de Valencia dados por átomos de oxígeno = 6*1 = 6
- electrones de Valencia Totales = 2 + 6 = 8
pares de electrones de Valencia Totales
pares de electrones de Valencia Totales = enlaces σ + enlaces π + pares solitarios en capas de Valencia
los pares totales de electrones se determinan dividiendo el número total de electrones de Valencia por dos. Para, H2O, pares Totales de electrones son 4 en sus capas de Valencia.,
átomo central de H2O
para ser el átomo central, la capacidad de tener una cenefa mayor es importante. Entonces, del hidrógeno y el oxígeno, ¿qué átomo tiene la valencia más alta? Valencia máxima de oxígeno es dos. la única Valencia del hidrógeno es una. Por lo tanto, el átomo de oxígeno debe ser el átomo central de H2O. ahora, podemos dibujar un bosquejo de H2O para mostrar cómo los átomos están ubicados en la molécula.
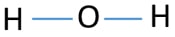
pares solitarios en átomos
después de determinar el átomo central y el bosquejo de la molécula H2O, debemos comenzar a marcar pares solitarios en átomos., Recuerde que, hay un total de cuatro pares de electrones.
- ya hay dos enlaces H-O en la estructura de croquis dibujada. Ahora solo quedan dos (4-2) pares de electrones para marcar en los átomos.
- Por lo general, los pares de electrones restantes deben comenzar a marcar en los átomos externos. Pero en H2O, el átomo de hidrógeno son los átomos externos que no pueden mantener más de dos electrones en su última capa. Por lo tanto, no podemos marcar esos dos pares de electrones en átomos de hidrógeno.,
- Luego, marque esos dos pares de electrones en el átomo central; oxígeno

marque las cargas en los átomos
no hay cargas en los átomos de oxígeno y átomos de hidrógeno.
Compruebe la estabilidad y minimice las cargas en los átomos convirtiendo pares solitarios en enlaces
debido a que no hay cargas en los átomos, no es necesario reducir las cargas como un paso para dibujar la mejor estructura de lewis. Ya tenemos la mejor estructura de lewis para H2O.
preguntas
¿para qué se pueden extraer las estructuras de lewis similares al agua?,
en la estructura de lewis de la molécula de agua, hay dos enlaces sigma y dos pares solitarios alrededor de sulfuratom. El sulfuro de hidrógeno, difluoruro de oxígeno (F2O) tienen estructuras de lewis similares al agua.
Haga sus preguntas de química y encuentre las respuestas
tutoriales relacionados