Pyridinium chlorochromate (PCC) is a milder version of chromic acid.
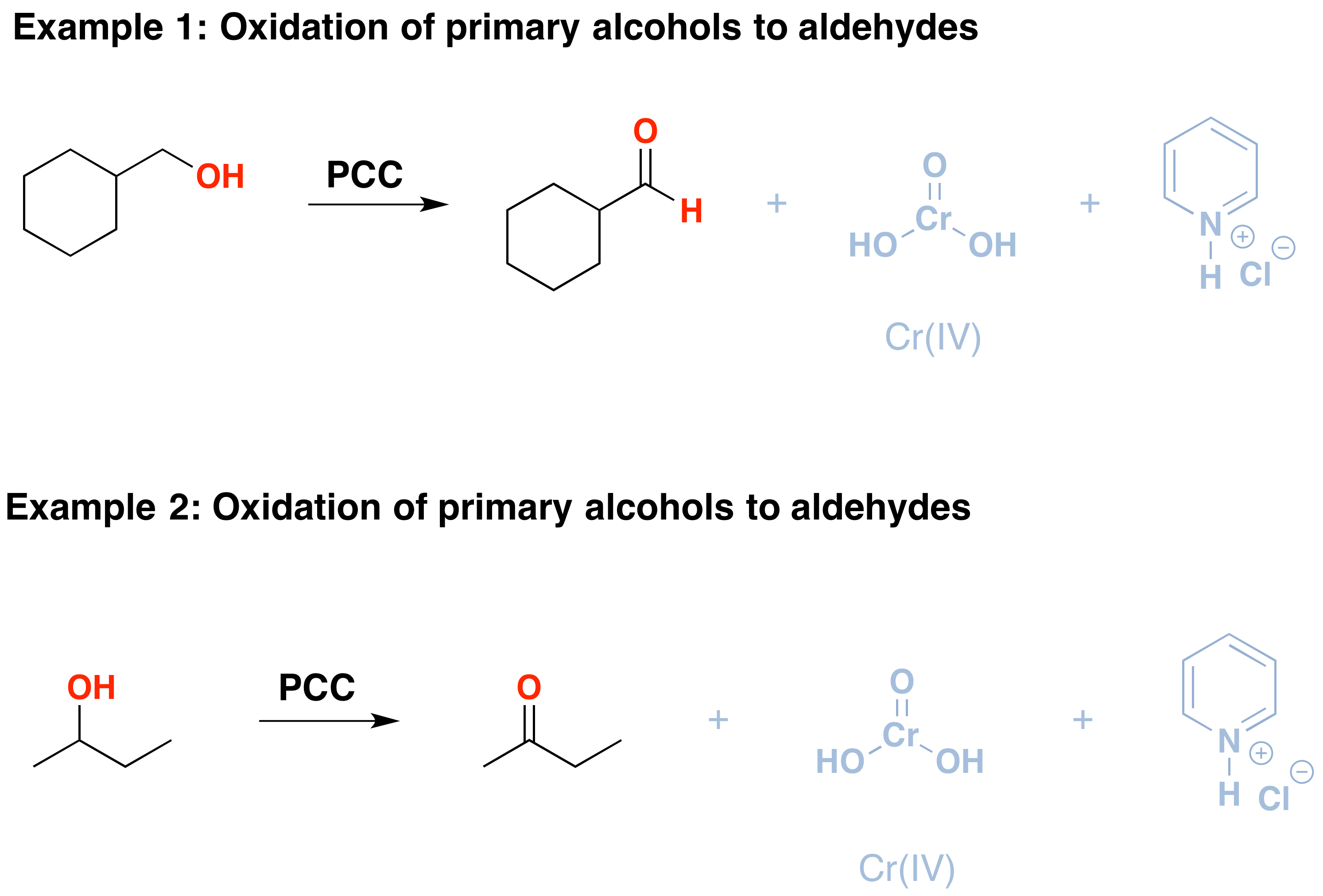
PCC oxidizes alcohols one rung up the oxidation ladder, from primary alcohols to aldehydes and from secondary alcohols to ketones. In contrast to chromic acid, PCC will not oxidize aldehydes to carboxylic acids., Ähnlich oder dasselbe wie: \(CrO_3\) und Pyridin (das Collins-Reagenz) oxidieren auch primäre Alkohole zu Aldehyden. Hier sind zwei Beispiele für PCC in Aktion.
- Wenn Sie einem dieser Alkohole ein Äquivalent von PCC hinzufügen, wird die oxidierte Version erzeugt. Die Nebenprodukte(in grau dargestellt) sind Cr (IV) sowie Pyridiniumhydrochlorid.
- Man muss vorsichtig mit der Wassermenge sein, die in der Reaktion vorhanden ist., Wenn Wasser vorhanden ist, kann es dem Aldehyd hinzufügen, um das Hydrat zu erzeugen, das durch ein zweites Äquivalent von PCC weiter oxidiert werden könnte, wenn es vorhanden ist. Dies ist kein Problem mit Ketonen, da kein H direkt mit C verbunden ist
Wie funktioniert es? Oxidationsreaktionen dieser Art sind eigentlich eine Art Eliminationsreaktion. Die Reaktion beginnt mit einer Kohlenstoff-Sauerstoff-Doppelbindung und führt zu einer Kohlenstoff-Sauerstoff-Doppelbindung., Die Eliminationsreaktion kann aufgrund der guten Austrittsgruppe auf dem Sauerstoff, nämlich dem Chrom, auftreten, das verdrängt wird, wenn die benachbarte C-H-Bindung mit einer Base gebrochen wird.
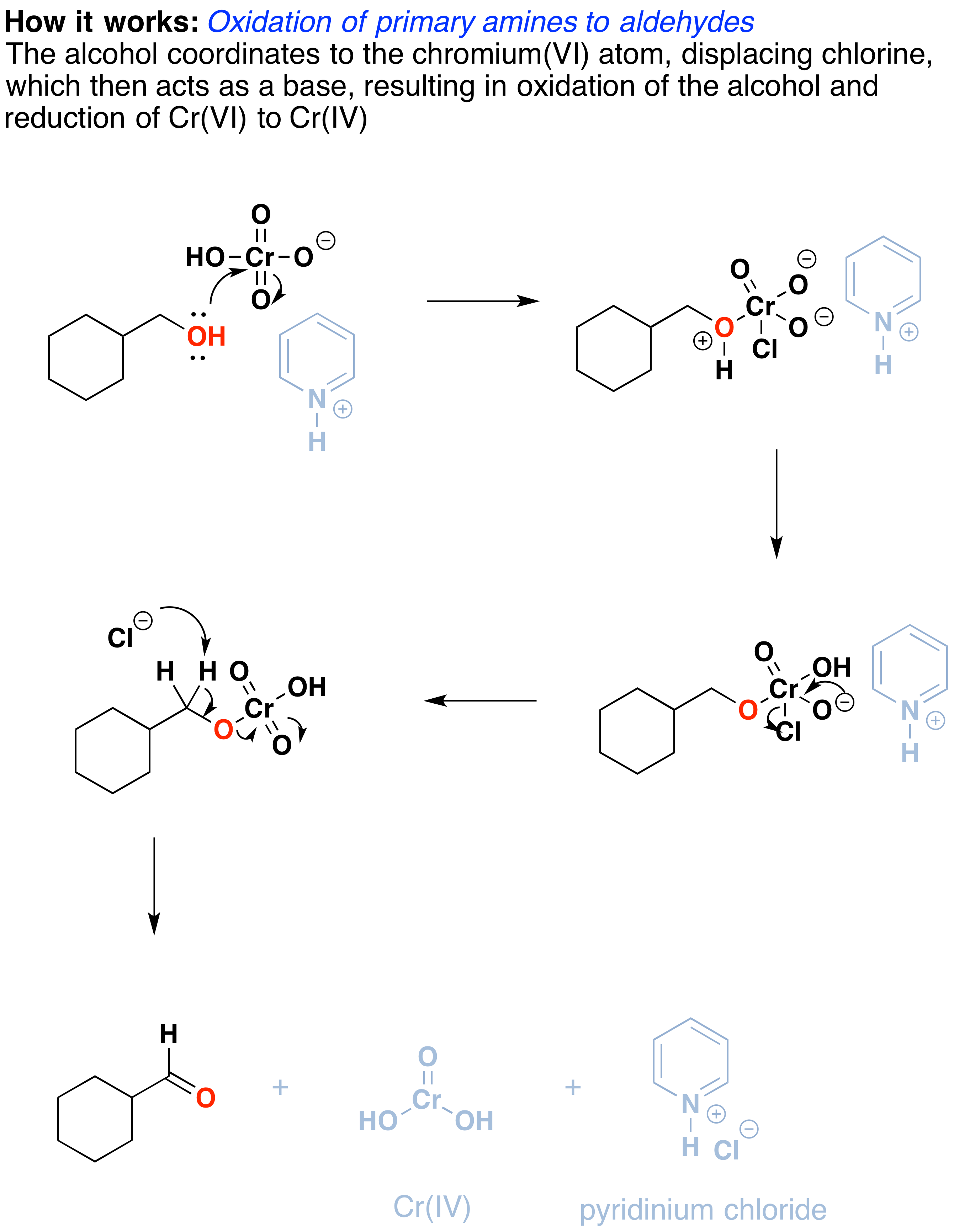
Der erste Schritt ist der Angriff von Sauerstoff auf die Chrom bilden die Cr-O-Bindung. Zweitens wird ein Proton auf dem (jetzt positiven) OH auf eines der Oxygene des Chroms übertragen, möglicherweise durch die Vermittlung des Pyridiniumsalzes., Ein Chloridion wird dann in einer Reaktion verdrängt, die an eine 1,2-Eliminationsreaktion erinnert, um einen sogenannten Chromatester zu bilden.
Die C-O-Doppelbindung wird gebildet, wenn eine Base das Proton auf dem Kohlenstoff neben dem Sauerstoff entfernt. Die Elektronen aus der C-H-Bindung bewegen sich zur Bildung der C-O-Bindung, und dabei wird die O-Cr-Bindung gebrochen, und Cr(VI) wird Cr(IV) (hier als O=Cr(OH)2 gezeichnet ).,
Real life notes: Wenn Sie PCC im Labor verwenden, vergessen Sie nicht, Molekularsiebe oder Celite oder einen anderen Feststoff auf den Boden des Kolbens zu geben, da Sie sonst einen unangenehmen braunen Teer erhalten, der schwer zu reinigen ist. Die Toxizität und das Chaos im Zusammenhang mit Chrom haben die Entwicklung anderer Alternativen wie TPAP, IBX, DMP und einer Vielzahl anderer Reagenzien vorangetrieben, die Sie im Allgemeinen erst nach dem Schulabschluss kennenlernen.
Mitwirkende
-
James Ashenhurst (MasterOrganicChemistry.com)