Einleitung
Lipase katalysiert den Abbau von Lipiden durch Hydrolyse der Ester von Fettsäuren. Seine Funktion ist wichtig für die Verdauung und Förderung der Aufnahme von Fetten im Darm. Lipase kommt hauptsächlich in der Bauchspeicheldrüse vor und wird von ihr ausgeschieden, kommt aber auch im Speichel und Magen vor.
- Pankreaslipase (PDB ID: 1hpl), die rechts abgebildet ist, ist eine Carbonsäureesterhydrolase. Es wird auch allgemein Pankreas-Triacylglycerollipase genannt und seine Enzymklassenzahl ist E. C. 3.1.1.3 .,
- Die gallensalzstimulierte Lipase (BSSL) findet sich in der Muttermilch.
- Die hormonempfindliche Lipase (LIPE) hydrolysiert eine Vielzahl von Estern. Für Details siehe hormonsensitive Lipase.
- Monoacylglycerollipase (MAGL) hydrolysiert intrazelluläre Triglyceride zu Fettsäure und Glycerin. MAGL funktioniert zusammen mit LIPE. Für Details siehe Monoglycerid-Lipase.
Die vom Enzym katalysierte Reaktion ist unten dargestellt.
Ein weiterer Abbau führt letztendlich zu 2-Monoacylglycerolen und freien Fettsäuren ., Eine eingehende Diskussion des Mechanismus findet sich im Abschnitt Lipase Catalytic Mechanism. Die Bestimmung der Struktur und Funktion der Lipase war ein allmählicher Prozess. Die Lipase-Aktivität wurde erstmals 1846 von Claude Bernard in der Bauchspeicheldrüse nachgewiesen. Erst 1955 zeigten Mattson und Beck eine hohe Spezifität der Pankreaslipase für Triglycerid-Primärester . In den letzten Jahren ist die Bestimmung der Kristallstruktur der Pankreaslipase zum Hauptfokus geworden, da viele Wissenschaftler daran gearbeitet haben.,
Siehe auch
- Molekulare Li/Pankreaslipase
- Lipase lid morph
- Hormonempfindliche Lipase
- Lipase aus Candida antarctica im geschlossenen Zustand
- Monoglyceridlipase
- Lipase (hebräisch)
- br>
- Fettstoffwechsel
Menschliche Magenlipase
Struktur
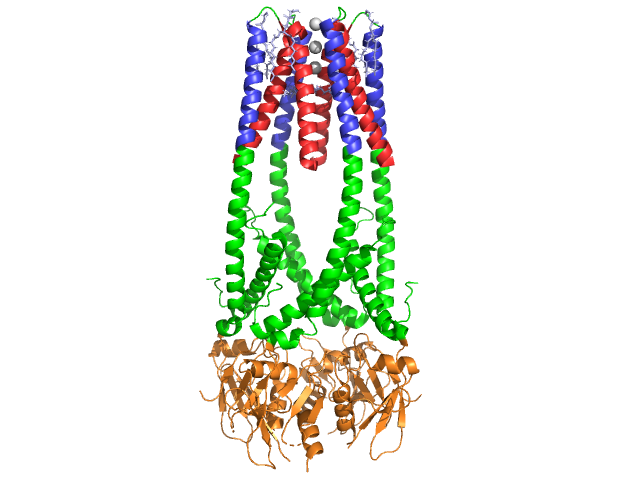
Pankreaslipase ist ein 50-kDa-Protein., Während die kristallographische asymmetrische Einheit zwei identische Ketten enthält, zeigen Informationen (ANMERKUNG 350) in der Datendatei 1hpl an, dass das Dimer ein Kristallisationsartefakt ist und dass die funktionelle Form (auch biologische Baugruppe genannt) eine einzelne Kette (Monomer) ist. Die Kette besteht aus 449 Rückständen . Die s der Lipase (in einer Untereinheit) umfassen 102 Rückstände, die 13 Alpha-Helices erzeugen, die rot dargestellt sind, und 139 Rückstände, die an Beta-Blättern mit insgesamt 28 Strängen beteiligt sind, die in Gold dargestellt sind. Die Alpha-Helices machen 22% des Proteins aus, während die Beta-Sheets 30% ausmachen., Jede Kette enthält zwei gut definierte . Die in blau gezeigte N-terminale Domäne ist durch eine Alpha/Beta-Hydrolase-Falte gekennzeichnet. Während die C-Terminaldomäne, grün dargestellt, ein Beta-Sheet-Sandwich enthält, das mit Colipase interagiert . Jede Monomer – und Dimerstruktur der Lipase wird durch Disulfidbindungen, Wasserstoffbrücken und elektrostatische Wechselwirkungen (Salzbrücken) zusammengehalten. Lipase hat insgesamt 12 zwischen Cysteinresten. werden zwischen den positiv geladenen Nitrogenen (blau) in Arg und Lys und negativen Oxygenen (rot) in Asp-und Glu-Rückständen gebildet., (in gelb) stabilisieren auch das Enzym zwischen Hauptkette und Seitenkette Atome. Lipase hat eine deutliche Verteilung der Rückstände (lila Spacefill steht für polare Rückstände). Der hydrophobe Kollaps trägt zu einem Großteil der sekundären und tertiären Strukturen bei, da die (in weiß gezeigten) das Innere des Proteins ausmachen, während sich polare Rückstände (transparent blau) auf der Oberfläche befinden . Darüber hinaus hat Lipase zwei . Eine ist in jeder Monomer-Untereinheit begraben. Das Calciumion ist essentiell für die Proteinfaltung und Enzymaktivität ., Das Bild zeigt das grüne Calciumion in der Untereinheit A, koordiniert durch Glu187 -, Arg190 -, Asp192-und Asp195-Rückstände. Die Ca (+2) – Ladung wird durch negativ geladene Glutamat-und Aspartatreste und die Sauerstoffatome aus zwei Wassermolekülen (rosa) stabilisiert.
Zusätzlich hat Lipase eine einzigartige (grüne), die verhindert, dass Lösungsmittel in die aktive Stelle gelangen (rot). Der Deckel ist eine 25-Mm-spiralförmige Struktur, die das Oxyanionloch schützt., Der Deckel (gelb) ist besonders wichtig für die Substratbindung, da er eine dramatische Verschiebung durchläuft, die die Sekundärstruktur der Lipase-Bindungsstelle von einer (aktiven Stelle in Rot) zu einer (aktiven Stelle in Blau, Triacylglycerid in Spacefill) verändert (siehe Lipase Lid Morph für eine Animation dieses Übergangs). Die Deckelöffnung wird von einer Veränderung der Sekundärstruktur von einer meist beta-verlängerten Struktur zu einer Struktur begleitet, bei der mehr als die Hälfte der aktiven Stelle aus Alpha-Helices gebildet wird .,
Colipase-Coenzym
Lipase wird durch Colipase aktiviert, ein Coenzym, das an die C-terminale, nicht katalytische Lipase-Domäne bindet. Colipase ist ein 10kDa-Protein, das von der Bauchspeicheldrüse in inaktiver Form ausgeschieden wird. Es hat fünf konservierte (gelb dargestellt) und 2 – eine hydrophile Oberfläche (Stelle der Lipase C-terminalen Wechselwirkung – blau dargestellt) und eine hydrophobe Oberfläche (enthält mehrere hydrophobe Schleifen zur Überbrückung des Lipids – weiß dargestellt). Trypsin aktiviert dann Colipase, bevor der Cofaktor mit Lipase interagieren kann.,
Colipase muss zur Aktivierung der Lipase vorhanden sein und fungiert als Brücke zwischen Lipase und dem Lipid. Wenn Colipase bindet, wird aktive Lipase für die hydrophobe Wechselwirkung mit Triacylglyceriden stabilisiert . Ohne vorhandene Kolipase würde die Ansammlung von Amphiphilen an der Öl-Wasser-Grenzfläche im Zwölffingerdarm die Bindung der Pankreaslipase an ihr Substrat verhindern. . Colipase und Lipase sind gegenüber der aktiven Stelle am C-Terminal (Kontakte sind Bereiche von rosa und Gelb, mit Wassermolekülen in dunklerem Blau). Die Enzyme sind durch polare Wechselwirkungen wie, und gebunden .,
In Gegenwart von Colipase wird das Enzym aktiviert, das die (rot gezeigte, aktive Stelle in Grün), die aus Aminosäuren 216-239 besteht, bewegt. Die N-Terminal-Klappe bewegt sich konzertiert zusammen mit der C-Terminal-Domäne, um die aktive Stelle (grün) zu offenbaren, so dass sie mit einem Substrat binden kann. Es wird vermutet, dass diese Flexibilität bei der Bindung des Colipase-Lipase-Komplexes an die Wasser-Lipid-Grenzfläche eine Bedeutung haben kann. Die Reorganisation der Klappe induziert auch eine zweite Konformationsänderung, die das Oxyanionloch erzeugt.,
Lipase-katalytischer Mechanismus
Die Lipase-Aktivierung an der Lipid-Wasser-Grenzfläche von Triacylglyceriden in Gegenwart von Colipase und Gallensalzen wird als Grenzflächenaktivierung bezeichnet. Damit die Hydrolysereaktion stattfindet, verankert Colipase Lipase an der Lipidwassermembran der Mizelle, was eine Oberflächenveränderung der Lipase verursacht. Die vier hydrophoben Schleifen von Colipase interagieren mit der hydrophoben Atmosphäre des Triacylglycerids. Dies initiiert aktive Standortbindung an das Lipid und Deckelöffnung, um eine hydrophobe Umgebung für das Triacylglycerin zu offenbaren., Dies wiederum ermöglicht es dem Triacylglycerin, mit wichtigen aktiven Stellenresten wie der katalytischen Triade zu interagieren. Eine Vielzahl von Lipase-Enzymen kann in der Natur gefunden werden. Obwohl die verschiedenen Formen verschiedene Proteingerüste einnehmen, sind die meisten auf einer Alpha/Beta-Hydrolase-Falte aufgebaut und besitzen ein chymotrypsinähnliches Protein, das aus einem sauren Rückstand, einem Histidin und einem Serin-Nukleophilen besteht. Im Falle der Pankreaslipase des Pferdes besteht die katalytische Triade aus . Diese katalytische Triade funktioniert wie die meisten in der Natur., Zunächst bildet Asparaginsäure eine Wasserstoffbindung mit His 263, wodurch die pKa des Histidin-Imidazolstickstoffs erhöht wird. Dies ermöglicht es dem Histidin, als starke allgemeine Basis zu wirken und das Serin zu deprotonieren. Das deprotonierte Serin kann dann als Nucleophil dienen und das Estercarbonyl einer der Fettsäuren auf den 1 oder 3 Kohlensäuren des Glycerinrückgrats des Lipidsubstrats angreifen. Beim Angriff auf das Lipid wird ein negativ geladenes tetraedrisches Zwischenprodukt gebildet (Reaktion 1). Es wird im Oxyanionloch durch zwei Rückstände stabilisiert:.,
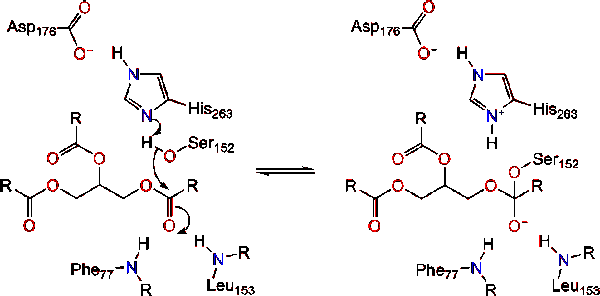
Die Carbonylgruppe mit dem Glycerin-Backbone-Segment als Ausgangsgruppe (Reaktion 2).
Ein Wassermolekül spendet dann ein Proton an das Histidin und erzeugt ein reaktives Hydroxylanion. Das Hydroxylanion kann dann den Carbonylkohlenstoff des Lipids angreifen und ein weiteres negativ geladenes tetraedrisches Zwischenprodukt bilden, das im Oxyanionloch stabilisiert ist (Reaktion 3).,
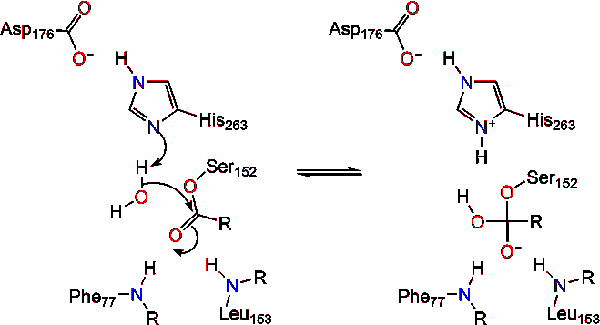
Bei Reformation des Carbonyls wird das katalytische Serin freigesetzt und Monoglycerid-und Fettsäuremonomere diffundieren weg (Reaktion 4).
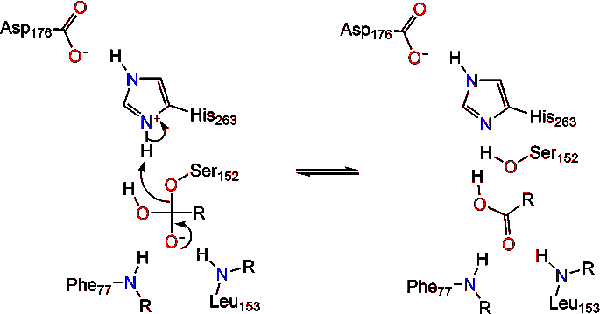
Hemmung der Pankreaslipase
(lila), ein C11-Alkylphosphonat, ist ein kompetitiver Inhibitor der Pankreaslipase. Es bindet direkt in der aktiven Tasche. Es gibt auch fünf B-Octylglucosid (grau und rot) Moleküle, die mit Lipase assoziieren., MUP bildet Wasserstoffbindungen mit: Ser 152 und His 263, die Teil der katalytischen Triade sind, und Phe 77 und Leu 153, die die stabilisierenden Rückstände im Oxyanionloch sind .MUP wurde durch van der Waals Kontakte mit hydrophoben Seitenketten Ala 178, Phe 215, Pro l80, Tyr ll4, Leu 213 (blau dargestellt) nachgewiesen.
Protein-Substrat-Wechselwirkungen
Lipase bindet mit zahlreichen hydrophoben Kontakten. Wie hier zu sehen ist, interagiert die Lipase mit der Alkylgruppe von Cholesteryllinoleat über einen hydrophoben Riss innerhalb des Proteins., Dieser Riss richtet das Molekül aus, um die Lipolysereaktion zu optimieren.
Gezeigt in dieser Szene ist Lipase aus der Hefe Candida rugosa in mit zwei Molekülen Cholesteryllinoleat (grau). Die aktiven Standortrückstände einschließlich Ser152, Asp176 und His263 sind in roter Strichdarstellung dargestellt. Lipase kann zwei Lipidmoleküle aufnehmen, da zwei identische Untereinheiten eine identische Reaktion katalysieren. Ein Lipase-Molekül kann zwei Lipolyse-Reaktionen gleichzeitig katalysieren.,
Klinische Bedeutung
Pankreaslipase wird durch das Kanalsystem der Bauchspeicheldrüse in den Zwölffingerdarm ausgeschieden. Bei einem gesunden Menschen ist es im Serum sehr niedrig konzentriert. Unter extremen Störungen der Pankreasfunktion, wie Pankreatitis oder Bauchspeicheldrüsenkrebs, kann die Bauchspeicheldrüse beginnen, sich selbst zu verdauen und Pankreasenzyme einschließlich Pankreaslipase in Serum freizusetzen. Die Messung der Serumkonzentration der Pankreaslipase kann daher bei der Diagnose einer akuten Pankreatitis helfen.., Aufgrund der Lipase-Aktivität bei der Verdauung und Absorption von Fett gab es einen wachsenden Markt für Lipase-Inhibitoren für Arzneimittel zur Gewichtsreduktion. Am beliebtesten ist Orlistat (oder Xenical®), ein Naturprodukt von Streptomyces toxytricini und das Hydrierungsprodukt der Lipostation – ein irreversibler Lipase-Inhibitor. Dieser Inhibitor wirkt auch durch Bindung von Seren und erzeugt einen Ester, der so langsam hydrolysiert, dass er praktisch irreversibel ist .
3D Strukturen von Lipase
Lipase 3D Strukturen