Was ist ein Ion?
Ein Ion ist ein Atom oder Molekül, das eine elektrische Ladung trägt.
Ionen werden durch die Verwendung eines Aufsatzes identifiziert, um das Vorzeichen und die Größe ihrer elektrischen Ladung anzuzeigen.
Anionen und Kationen
Negativ geladene Ionen werden Anionen genannt, und positiv geladene Ionen werden Kationen genannt.,n Atom gewinnt drei Elektronen zu werden N3-
Beispiele für Kationen
- ein Natriumatom verliert ein Elektron zu werden Na+
- ein Magnesiumatom verliert zwei Elektronen zu werden Mg2+
- ein Eisenatom verliert drei elektronen werden Fe3+
- Wasser reagiert mit H+, um das molekulare Kation H3O+
Ionenbildung zu bilden
Ionen bilden dabei minimiert die gesamte potentielle Energie der an der chemischen Reaktion beteiligten chemischen Spezies.,Oft wird dies erreicht, indem Atome verschiedener Elemente eine volle Elektronenhülle erreichen können.
Betrachten Sie das Salz Lithiumfluorid:
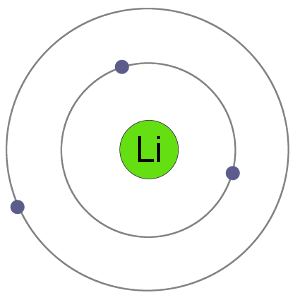
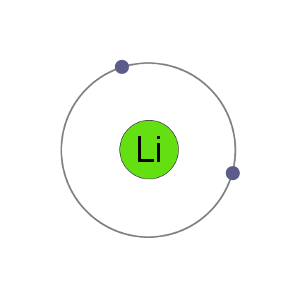
Lithiumatome haben 3 Elektronen, dh sie haben Elektronen in zwei Schalen: 2 in der ersten Schale und 1 in der second.By wenn Lithium ein Elektron verliert, um ein Kation zu werden, erhält es eine stabile Elektronenanordnung, die mit der des Edelgases Helium identisch ist.,
Li-Atom
Li+ – Kation
– Fluor-Atome mit 9 Elektronen, d.h. Sie haben 2 in der ersten Schale 7 second.By gewinnt ein Elektron zu einem anion der Fluorid-Ionen wird eine stabile Elektronen-Anordnung, identisch mit dem Edelgas neon.,“e9c2d99c83″>
Und so ist die Redoxreaktion von Natrium mit Chlor zur Bildung einer ionischen Verbindung energetisch günstig:
Reduktion von Chlor: Cl2 + 2e- → 2Cl-
Gesamtreaktion: 2Na + Cl2 → 2NaCl
Ionengrößen
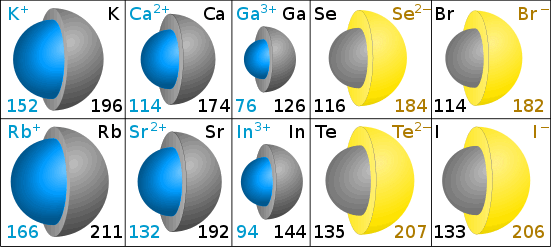
Kationen sind kleiner als das ursprüngliche Atom – überlegen Sie, wie das Natriumatom Elektronen in drei Schalen hat, während das Natriumion Elektronen in nur zwei Schalen hat.,Mit mehr Elektronen sind Anionen größer als das ursprüngliche Atom.
Ionengrößen werden durch den Ionenradius gemessen.
Ionenradien in Pikometern
Die graue Farbe in den Diagrammen zeigt die Größe des ursprünglichen Atoms. Das Blau (Kation) und Gelb (Anion) zeigt die Größe des Ions. (Diagramme von Chris King.)

Ionische Verbindungen
Ionische Verbindungen wie Natriumchlorid (NaCl) werden aufgrund der elektrostatischen Anziehung zwischen Anionen und Kationen gebildet.,Ionische Verbindungen sind elektrisch neutral, da die Gesamtzahl der positiven Ladungen und die Gesamtzahl der negativen Ladungen immer gleich sind.
Unter Berücksichtigung der chemischen Elemente besteht die höchste Tendenz zur Bildung ionischer Verbindungen in den am wenigsten elektronegativen Metallen und den elektronegativsten Nichtmetallen.
Elektrische Leiter
Ionen können elektrischen Strom tragen; dies kann beispielsweise in elektrochemischen Zellen und im Plasma beobachtet werden.
Im Allgemeinen tragen feste ionische Verbindungen keinen elektrischen Strom, da die Ionen in einem Kristallgitter in festen Positionen eingeschlossen sind.,Ionische Verbindungen leiten Elektrizität nur, wenn sie geschmolzen oder in Lösung gelöst sind, wenn die Ionen aus dem Kristallgitter freigesetzt werden und beweglich werden.