Die hochorganisierten Strukturen von Proteinen sind wahre Meisterwerke der chemischen Architektur. Aber hochorganisierte Strukturen neigen dazu, eine gewisse Delikatesse zu haben, und das gilt für Proteine. Denaturierung ist der Begriff für jede Änderung der dreidimensionalen Struktur eines Proteins, die es unfähig macht, seine zugewiesene Funktion auszuführen. Ein denaturiertes Protein kann seine Arbeit nicht tun. (Manchmal wird die Denaturierung mit der Ausfällung oder Koagulation eines Proteins gleichgesetzt; Unsere Definition ist etwas breiter.,) Eine Vielzahl von Reagenzien und Bedingungen, wie Hitze, organische Verbindungen, pH-Veränderungen und Schwermetallionen können Protein Denaturierung verursachen.
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
Verwendung organischer Verbindungen wie Ethylalkohol |
Diese Verbindungen sind in der Lage, intermolekulare Wasserstoffbindungen mit Proteinmolekülen durchzuführen und die intramolekulare Wasserstoffbindung innerhalb des Proteins zu stören., |
|
Salze von Schwermetallionen wie Quecksilber, Silber und Blei |
Diese Ionen bilden starke Bindungen mit den Carboxylatanionen der sauren Aminosäuren oder SH-Gruppen von Cystein und stören Ionenbindungen und Disulfidverbindungen. |
|
Alkaloidreagenzien wie Gerbsäure (in Gerbleder verwendet) |
Diese Reagenzien verbinden sich mit positiv geladenen Aminogruppen in Proteinen, um Ionenbindungen zu stören., |
Jeder, der ein Ei gebraten hat, hat die Denaturierung beobachtet. Das klare Eiweiß wird undurchsichtig, wenn das Albumin denaturiert und koaguliert. Noch hat niemand diesen Prozess umgekehrt. Unter den richtigen Umständen und genügend Zeit kann sich jedoch ein Protein, das sich unter ausreichend schonenden Bedingungen entfaltet hat, wieder entfalten und kann wieder biologische Aktivität aufweisen (Abbildung 2.5.1). Solche Beweise deuten darauf hin, dass zumindest für diese Proteine die Primärstruktur die sekundäre und tertiäre Struktur bestimmt., Eine gegebene Sequenz von Aminosäuren scheint ihre besondere dreidimensionale (3D) Anordnung natürlich anzunehmen, wenn die Bedingungen stimmen.
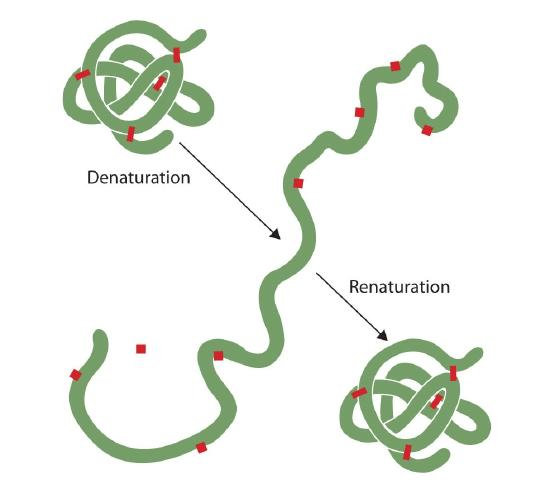
Die Primärstrukturen von Proteinen sind ziemlich robust., Im Allgemeinen sind ziemlich kräftige Bedingungen erforderlich, um Peptidbindungen zu hydrolysieren. Auf der sekundären bis quartären Ebene sind Proteine jedoch ziemlich anfällig für Angriffe, obwohl sie in ihrer Anfälligkeit für Denaturierung variieren. Die zart gefalteten kugelförmigen Proteine sind viel leichter zu denaturieren als die zähen, faserigen Proteine von Haar und Haut.
Zusammenfassung
Proteine können in zwei Kategorien unterteilt werden: faserig, die in Wasser unlöslich sind, und kugelförmig, die in Wasser löslicher sind. Ein Protein kann bis zu vier Strukturebenen aufweisen., Die Primärstruktur besteht aus der spezifischen Aminosäuresequenz. Die resultierende Peptidkette kann eine α-Helix oder β-plissierte Folie (oder lokale Strukturen, die nicht so leicht kategorisiert werden können) bilden, die als Sekundärstruktur bekannt ist. Diese Segmente der Sekundärstruktur sind in die Tertiärstruktur der gefalteten Polypeptidkette integriert. Die quartäre Struktur beschreibt die Anordnungen von Untereinheiten in einem Protein, das mehr als eine Untereinheit enthält., Vier Haupttypen attraktiver Wechselwirkungen bestimmen die Form und Stabilität des gefalteten Proteins: Ionenbindung, Wasserstoffbindung, Disulfidverbindungen und Dispersionskräfte. Eine Vielzahl von Reagenzien und Bedingungen kann dazu führen, dass sich ein Protein entfaltet oder denaturiert.