calor y temperatura son un tema estrechamente relacionado, y como tal, la diferencia entre los dos puede ser un poco confusa. La diferencia principal es que el calor se ocupa de la energía térmica, mientras que la temperatura se ocupa más de la energía cinética molecular.
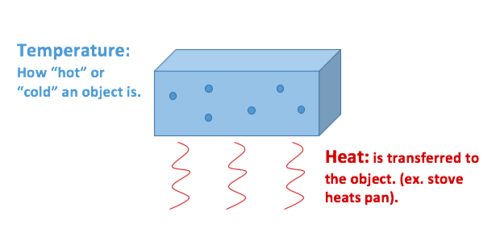
el Calor es la transferencia de energía térmica, mientras que la temperatura es una propiedad de los objetos expuestos.
¿Cuál es la diferencia?,
El calor describe la transferencia de energía térmica entre moléculas dentro de un sistema y se mide en julios. El calor mide cómo se mueve o fluye la energía. Un objeto puede ganar o perder calor, pero no puede tener calor. El calor es una medida de cambio, nunca una propiedad poseída por un objeto o sistema. Por lo tanto, se clasifica como una variable de proceso.
La temperatura describe la energía cinética promedio de las moléculas dentro de un material o sistema y se mide en grados Celsius (°C), Kelvin(K), Fahrenheit (°F) o Rankine (R)., Es una propiedad física medible de un objeto, también conocida como variable de estado. Otras propiedades físicas medibles incluyen velocidad, masa y densidad, por nombrar algunas.
similitudes
El calor es una transferencia de energía térmica causada por una diferencia de temperatura entre moléculas.
Nota:
La energía térmica puede entenderse como la energía cinética microscópica total y potencial de un sistema.,
Segunda Ley de la termodinámica
la segunda ley de la termodinámica es un tema complejo que requiere un estudio intensivo en el campo de la termodinámica para comprender realmente. Sin embargo, para el propósito de este artículo, solo un pequeño aspecto necesita ser entendido y es el hecho de que el calor siempre fluirá espontáneamente de sustancias más calientes a otras más frías. Esta simple declaración explica por qué un cubo de hielo no se forma afuera en un día caluroso o por qué se derrite cuando se deja caer en un tazón de agua tibia.,
experimento mental
Imagine el cubo de hielo antes mencionado caído en un tazón de agua tibia: el hielo debe ganar calor (energía térmica) del agua en el tazón (consulte el párrafo anterior). La adición de energía térmica conduce a un aumento en la energía cinética de la molécula de hielo, y por lo tanto un aumento en la temperatura. Esto se sabe porque la temperatura es, de hecho, la medida de la energía cinética media de las moléculas. Además, el hielo continuará ganando energía térmica causando que sus moléculas se muevan más rápido y eventualmente rompan sus enlaces intermoleculares o se derritan.,
En conclusión, la transferencia de calor o energía térmica se suelen cambiar la temperatura de la sustancia, pero no siempre! Por ejemplo, en el momento en que el hielo en el recipiente se convierte en agua, esas moléculas de agua estarán exactamente a la misma temperatura que cuando eran hielo. En este caso, en lugar de que la energía térmica trabaje para aumentar la energía cinética, sí trabaja para romper los enlaces intermoleculares, causando un cambio de estado., Sin embargo, a medida que pasa el tiempo, la temperatura del hielo recién derretido aumentará hasta que todo dentro del tazón alcance el equilibrio, lo que significa una temperatura constante en todo.
Para Leer Más
- el Calor
- Temperatura
- energía Térmica
- energía Cinética
- Interior de la energía
- O explorar una página al azar