Inledning
lipas katalyserar nedbrytningen av lipider genom hydrolysering av estrar av fettsyror. Dess funktion är viktig för matsmältning och främjande av absorption av fetter i tarmarna. Lipas finns främst i och utsöndras av bukspottkörteln, men finns också i saliv och mage.
- pankreaslipas (PDB ID: 1hpl) som är bilden till höger, är en karboxylsyraester hydrolas. Det kallas också ofta pankreas triacylglycerol lipas och dess enzymklass nummer är E. C. 3.1.1.3 .,
- gallsaltstimulerat lipas (bssl) finns i bröstmjölk.
- hormonkänsligt lipas (LIPE) hydrolyserar en mängd olika estrar. För mer information se hormonkänsligt lipas.
- Monoacylglycerol lipas (MAGL) hydrolyserar intracellulära triglycerider till fettsyror och glycerol. MAGL fungerar tillsammans med LIPE. För mer information se Monoglycerid lipas.
reaktionen som katalyseras av enzymet visas nedan.
ytterligare uppdelning resulterar slutligen i 2-monoacylglyceroler och fria fettsyror ., En fördjupad diskussion av mekanismen finns i Lipaskatalysatorsektionen. Bestämningen av lipas struktur och funktion var en gradvis process. Lipasaktivitet visades först i bukspottkörteln av Claude Bernard 1846. Det var dock inte förrän 1955 som Mattson och Beck visade en hög specificitet av pankreaslipas för triglycerid primära estrar . Under de senaste åren har bestämning av kristallstrukturen hos pankreaslipas blivit det primära fokuset, eftersom många forskare har arbetat för att främja detta.,
Se även
- Molekylär lekplats/pankreas lipas
- lipas lock morph
- hormonkänsligt lipas
- lipas från Candida Antarktis i stängt tillstånd
- Monoglycerid lipas
- Human gastric lipas
- li>li> lipas (Hebreiska)
- lipidmetabolism
struktur
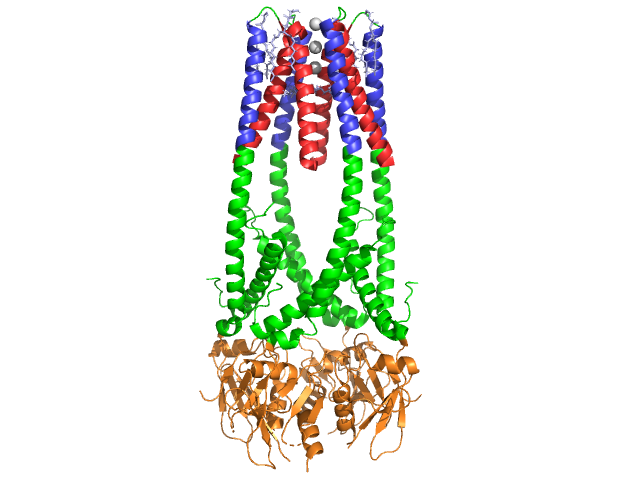
pankreaslipas är ett 50 kDa-protein., Medan den kristallografiska asymmetriska enheten innehåller två identiska kedjor, indikerar information (anmärkning 350) i datafilen 1hpl att dimer är en kristalliseringsartefakt och att den funktionella formen (även kallad den biologiska enheten) är en enda kedja (monomer). Kedjan består av 449 rester . S av lipas (i en subenhet) inkluderar 102 rester som skapar 13 alfa helices, visas i rött, och 139 rester involverade i beta ark totalt 28 strängar, visas i guld. Alfa helices står för 22% av proteinet, medan beta-arken utgör 30%., Varje kedja innehåller två väldefinierade . N-terminaldomänen, som visas i blått, kännetecknas av en alfa / beta-hydrolas-vik. Medan C-terminaldomänen, som visas i grönt, innehåller en betaarksmörgås som interagerar med kolipas . Varje monomer och dimerstruktur av lipas hålls samman av disulfidbindningar, vätebindningar och elektrostatiska interaktioner (saltbroar). Lipas har 12 totalt mellan cysteinrester. bildas mellan de positivt laddade nitrogenerna (blå) i Arg och Lys, och negativa oxygener (röd) i Asp-och Glu-rester., (i gult) stabiliserar också enzymet mellan huvudkedjans och sidokedjans atomer. Lipas har en distinkt fördelning av rester (lila spacefill representerar polära rester). Hydrofob kollaps bidrar till en stor del av de sekundära och tertiära strukturer, som (visas i vitt) utgör det inre av proteinet, medan polära rester (transparent blå) är på ytan . Dessutom har lipas två . En är begravd i varje monomer subenhet. Kalciumjonen är nödvändig för proteinvikning och enzymaktivitet ., Bilden visar den gröna kalciumjonen i subenhet A, samordnad av Glu187, Arg190, Asp192 och Asp195 rester. Ca (+2) laddningen stabiliseras av negativt laddade glutamat-och aspartatrester och syreatomerna från två vattenmolekyler (rosa).
dessutom har lipas en unik (grön) som blockerar lösningsmedlet från att komma in på den aktiva platsen (röd). Locket är en 25-Rest spiralstruktur som skyddar oxyanionhålet., Locket (gult) är särskilt viktigt för substratbindning eftersom det genomgår en dramatisk förändring som förändrar den sekundära strukturen hos lipasbindningsstället från en (aktiv plats i rött) till en (aktiv plats i blått, triacylglycerid i spacefill) (se lipas lock morph för en animering av denna övergång). Locköppningen åtföljs av en förändring i sekundär struktur från en mestadels beta-utökad bekräftelse till en struktur där mer än hälften av den aktiva platsen bildas från alfahelices .,
Kolipaskoenzym
lipas aktiveras av kolipas, ett koenzym som binder till lipas C-terminala, icke-katalytiska domän. Colipase är en 10kDa protein som utsöndras av bukspottkörteln i en inaktiv form. Den har fem bevarade (visas i gult) , och 2 – en hydrofil yta (plats för lipas C-terminal interaktion – visas i blått) och en hydrofob yta (innehåller flera hydrofoba slingor för att överbrygga lipid – visas i vitt). Trypsin aktiverar sedan kolipas innan kofaktorn kan interagera med lipas.,
Kolipas måste vara närvarande för aktivering av lipas och fungerar som en bro mellan lipas och lipid. När kolipas binds stabiliseras aktivt lipas för den hydrofoba interaktionen med triacylglycerider . Utan kolipas närvarande skulle ackumuleringen av amfifiler vid olje – /vattengränssnittet i duodenum förhindra att pankreaslipas binds till dess substrat. . Kolipas och lipas är motsatta av den aktiva platsen på C-terminalen(kontakter är regioner av rosa och gult, med vattenmolekyler som visas i mörkare blå). Enzymerna är bundna av polära interaktioner såsom, och .,
i närvaro av kolipas aktiveras enzymet som flyttar (visas i rött, aktivt område i grönt) som består av aminosyror 216-239. N-terminalfliken rör sig på ett samordnat sätt tillsammans med C-terminaldomänen för att avslöja den aktiva platsen (grön), så att den kan binda med ett substrat. Det är hypotetiskt att denna flexibilitet kan ha betydelse för att binda kolipas-lipaskomplexet med vatten-lipidgränssnittet. Omorganisationen av klaffen inducerar också en andra konformationsförändring som skapar oxyanionhålet.,
lipas katalytisk mekanism
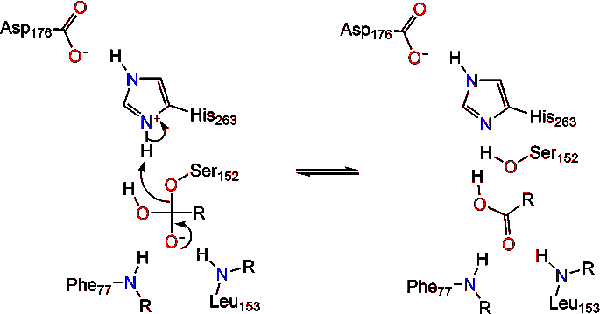
lipas aktivering vid lipid-vatten gränssnitt av triacylglycerider, i närvaro av kolipas och gallsalter, är känd som interfacial aktivering. För att hydroloysreaktionen ska äga rum förankrar kolipas lipas till lipid-vattenmembranet i micellen vilket orsakar en ytförändring på lipas. Kolipas fyra hydrofoba slingor interagerar med den hydrofoba atmosfären i triacylglyceriden. Detta initierar aktiv platsbindning till lipid och locköppning för att avslöja en mer hydrofob miljö för triacylglycerol., Detta i sin tur gör det möjligt för triacylglycerol att interagera med viktiga aktiva platsrester som den katalytiska triaden. Ett varierat utbud av lipasenzymer finns i naturen. Även om de olika formerna upptar olika proteinställningar, är de flesta byggda på en alfa / beta hydrolas-vik och har en chymotrypsinliknande bestående av en sur rest, en histidin och en serinnukleofil. I fallet med häst pankreaslipas består den katalytiska triaden av . Denna katalytiska triad fungerar som de flesta som finns i naturen., Först bildar asparaginsyra en vätebindning med sin 263, vilket ökar PKA av histidin imidazolkvävet. Detta gör det möjligt för histidin att fungera som en kraftfull allmän bas och deprotonera serinen. Den deprotonerade serinen kan sedan fungera som en nukleofil och attackera esterkarbonylen av en av fettsyrorna på 1 eller 3-kolerna i glycerol-ryggraden i lipidsubstratet. Vid attack av lipiden bildas en negativt laddad tetrahedral mellanprodukt (reaktion 1). Det stabiliseras i oxyanionhålet med två rester:.,
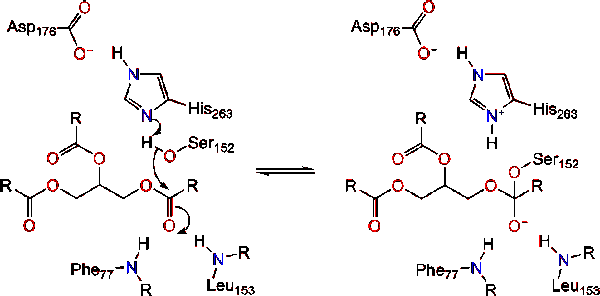
karbonylreformerna med glycerol-ryggraden som fungerar som den avgående gruppen (reaktion 2).
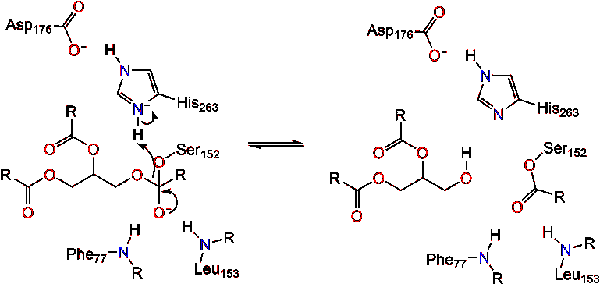
en vattenmolekyl donerar sedan en proton till histidin, vilket skapar en reaktiv hydroxylanjon. Hydroxylanionen kan sedan attackera lipidens karbonylkol och bilda en annan negativt laddad tetraedrisk mellanprodukt som stabiliseras i oxyanionhålet (reaktion 3).,
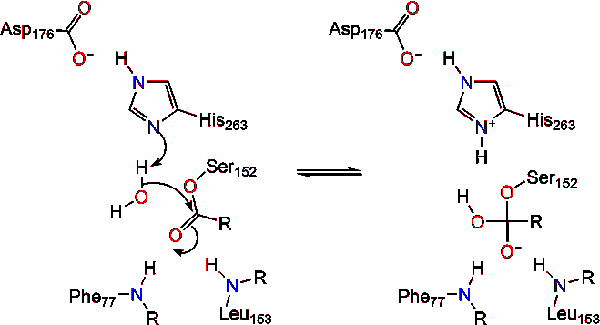
vid reformation av karbonylen frigörs katalytisk serin och monoglycerid och fettsyramonomerer diffunderar bort (reaktion 4).
hämning av pankreaslipas
(lila), en C11-alkylfosfonat, är en konkurrenskraftig hämmare av pankreaslipas. Den binder direkt i den aktiva platsfickan. Det finns också fem B-oktylglukosid (grå och röd) molekyler som associerar med lipas., MUP bildar vätebindningar med: Ser 152 och His 263, som ingår i den katalytiska triaden, och Phe 77 och Leu 153 som är de stabiliserande rester som finns i oxyanionhålet .MUP visat sig vara av van der Waals kontakter med hydrofoba sidokedjor Ala 178, Phe 215, Pro l80, Tyr ll4, Leu 213 (visas i blått).
Proteinsubstratinteraktioner
lipas binder med många hydrofoba kontakter. Som framgår här interagerar lipas med alkylgruppen av kolesteryllinoleat via en hydrofob rift i proteinet., Denna rift orienterar molekylen för att optimera lipolysreaktionen.
som visas i denna scen är lipas från jästen Candida rugosa in med två molekyler av kolesteryl linoleat (grå). Den aktiva webbplatsen restprodukter inklusive Ser152, Asp176, och His263 visas i rött stick representation. Lipas kan rymma två lipidmolekyler på grund av att det är två identiska subenheter katalyserar en identisk reaktion. En lipasmolekyl kan katalysera två lipolysreaktioner åt gången.,
klinisk betydelse
pankreaslipas utsöndras i duodenum genom kanalsystemet i bukspottkörteln. I en frisk individ är den vid mycket låg koncentration i serum. Under extrem störning av bukspottkörtelns funktion, såsom pankreatit eller bukspottkörtelcancer, kan bukspottkörteln börja smälta sig och frigöra pankreasenzymer inklusive pankreaslipas i serum. Mätning av serumkoncentrationen av pankreaslipas kan därför hjälpa vid diagnos av akut pankreatit.., På grund av lipasaktivitet i matsmältning och absorption av fett har det funnits en växande marknad för lipasinhibitorer för viktminskning läkemedel. Den mest populära är Orlistat (eller Xenical®) som är en naturlig produkt från Streptomyces toxytricini och är hydrogeneringsprodukten av lipostation – en irreversibel lipas-hämmare. Denna hämmare verkar också genom att binda Ser152, som producerar en ester som hydrolyserar så långsamt att det är praktiskt taget irreversibelt .
3D strukturer av lipas
lipas 3D strukturer