de högt organiserade strukturerna av proteiner är verkligen mästerverk av kemisk arkitektur. Men högorganiserade strukturer tenderar att ha en viss delikatess, och detta gäller proteiner. Denaturering är den term som används för någon förändring i den tredimensionella strukturen hos ett protein som gör det oförmöget att utföra sin tilldelade funktion. Ett denaturerat protein kan inte göra sitt jobb. (Ibland denaturering likställs med Utfällning eller koagulering av ett protein; vår definition är lite bredare.,) En mängd olika reagens och tillstånd, såsom värme, organiska föreningar, pH-förändringar och tungmetalljoner kan orsaka proteindenaturering.
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
användning av organiska föreningar, såsom etylalkohol |
dessa föreningar kan engagera sig i intermolekylär vätebindning med proteinmolekyler och störa intramolekylär vätebindning i proteinet., |
|
salter av tungmetalljoner, såsom kvicksilver, silver och bly |
dessa joner bildar starka bindningar med karboxylatanjonerna av de sura aminosyrorna eller Sh-grupperna av cystein, stör jonbindningar och disulfidlänkar. |
|
Alkaloidreagens, såsom tanninsyra (används i garvläder) |
dessa reagens kombineras med positivt laddade aminogrupper i proteiner för att störa jonbindningar., |
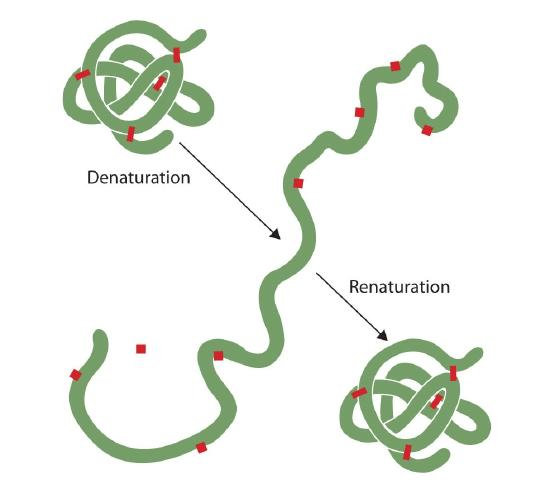
alla som har stekt ett ägg har observerat denaturering. Den klara äggvita blir ogenomskinlig när albumindenaturerna och koagulerar. Ingen har ännu vänt den processen. Med tanke på de rätta omständigheterna och tillräckligt med tid kan emellertid ett protein som har utvecklats under tillräckligt milda förhållanden återfyllas och åter uppvisa biologisk aktivitet (figur 2.5.1). Sådana bevis tyder på att, åtminstone för dessa proteiner, bestämmer den primära strukturen den sekundära och tertiära strukturen., En given sekvens av aminosyror verkar anta sitt speciella tredimensionella (3D) arrangemang naturligt om förhållandena är rätt.
proteins primära strukturer är ganska robusta., I allmänhet behövs ganska kraftiga förhållanden för att hydrolysera peptidbindningar. Vid sekundära genom kvartära nivåer är proteiner dock ganska sårbara för angrepp, även om de varierar i deras sårbarhet för denaturering. De delikat vikta globulära proteinerna är mycket lättare att denature än de tuffa, fibrösa proteinerna i hår och hud.
sammanfattning
proteiner kan delas in i två kategorier: fibrösa, som tenderar att vara olösliga i vatten och globulära, som är mer lösliga i vatten. Ett protein kan ha upp till fyra nivåer av struktur., Den primära strukturen består av den specifika aminosyrasekvensen. Den resulterande peptidkedjan kan bilda ett α-helix eller β-veckat ark (eller lokala strukturer som inte är så lätt kategoriserade), vilket är känt som sekundär struktur. Dessa segment av sekundär struktur är införlivade i den tertiära strukturen hos den vikta polypeptidkedjan. Den kvartära strukturen beskriver arrangemangen för subenheter i ett protein som innehåller mer än en subenhet., Fyra huvudtyper av attraktiva interaktioner bestämmer formen och stabiliteten hos det vikta proteinet: jonbindning, vätebindning, disulfidbindningar och dispersionskrafter. Ett brett utbud av reagens och tillstånd kan orsaka att ett protein utvecklas eller denaturen.