Introducere
lipaza catalizează descompunerea lipidelor prin hidrolizarea esterilor acizilor grași. Funcția sa este importantă pentru digestie și promovarea absorbției grăsimilor în intestine. Lipaza se găsește în principal în pancreas și este secretată de pancreas, dar se găsește și în salivă și stomac.
- lipaza pancreatică (PDB ID: 1HPL) care este ilustrată la dreapta, este o hidrolază de ester carboxilic. De asemenea, este denumit în mod obișnuit triacilglicerol lipază pancreatică, iar numărul clasei enzimatice este E. C. 3.1.1.3 .,
- lipaza stimulată de sare biliară (BSSL) se găsește în laptele matern.
- lipaza sensibilă la hormoni (LIPE) hidrolizează o varietate de esteri. Pentru detalii, consultați lipaza sensibilă la hormoni.
- lipaza Monoacilglicerol (MAGL) hidrolizează trigliceridele intracelulare în acid gras și glicerol. MAGL funcționează împreună cu LIPE. Pentru detalii vezi monogliceride lipaza.reacția catalizată de enzimă este prezentată mai jos.
defalcare Suplimentară în cele din urmă rezultate în 2-monoacylglycerols și acizi grași liberi ., O discuție aprofundată a mecanismului poate fi găsită în secțiunea mecanismului catalitic lipază. Determinarea structurii și funcției lipazei a fost un proces gradual. Activitatea lipazei a fost demonstrată pentru prima dată în pancreas de Claude Bernard în 1846. Cu toate acestea, abia în 1955 Mattson și Beck au demonstrat o specificitate ridicată a lipazei pancreatice pentru esterii primari ai trigliceridelor . În ultimii ani, determinarea structurii cristaline a lipazei pancreatice a devenit accentul principal, deoarece mulți oameni de știință au lucrat pentru a continua acest lucru.,
Vezi și
- Moleculară Joacă/Lipazei Pancreatice
- Lipaza capac transforma
- lipaza Hormon-sensibilă
- Lipaza din Candida antarctica în stare închisă
- Monogliceridă lipaza
- Uman lipaza gastrică
- Lipaza (ebraică)
- metabolismului Lipidic
Structura
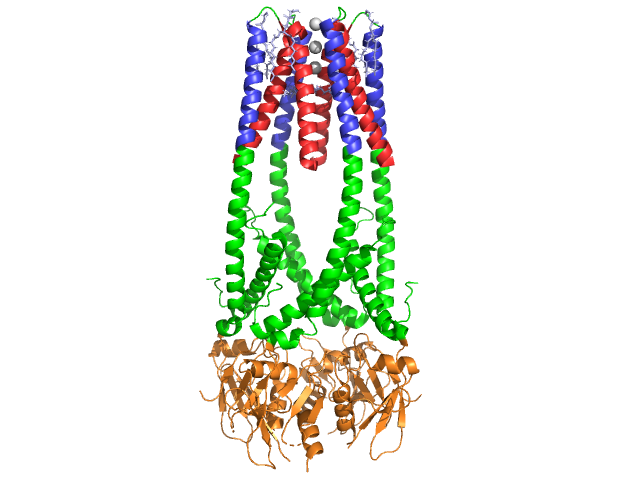
lipazei Pancreatice este de 50 kDa., În timp ce unitatea asimetrică cristalografică conține două lanțuri identice, informațiile (observația 350) din fișierul de date 1hpl indică faptul că dimerul este un artefact de cristalizare și că forma funcțională (numită și ansamblul biologic) este un singur lanț (monomer). Lanțul este format din 449 de reziduuri . S-ul lipazei (într-o subunitate) include 102 reziduuri care creează 13 helici alfa, arătate în roșu, și 139 reziduuri implicate în foi beta în valoare totală de 28 de fire, arătate în aur. Helicele alfa reprezintă 22% din proteină, în timp ce foile beta cuprind 30%., Fiecare lanț conține două bine definite . Domeniul terminal n, prezentat în albastru, este caracterizat printr-o pliantă alfa/beta hidrolază. În timp ce domeniul terminal C, prezentat în verde, conține un sandwich de foi beta care interacționează cu colipaza . Fiecare monomer și dimer structura lipazei sunt ținute împreună prin legături disulfidice, legături de hidrogen și interacțiuni electrostatice (poduri de sare). Lipaza are 12 total între reziduurile de cisteină. se formează între nitrogenii încărcați pozitiv (albastru) în Arg și Lys și oxygenii negativi (roșu) în reziduurile Asp și Glu., (în galben) stabilizează, de asemenea, enzima dintre atomii lanțului principal și cei ai lanțului lateral. Lipaza are o distribuție distinctă a reziduurilor (spațiul purpuriu reprezintă reziduuri polare). Colapsul hidrofob contribuie la o mare parte din structurile secundare și terțiare, deoarece (prezentat în alb) alcătuiesc interiorul proteinei, în timp ce reziduurile polare (albastru transparent) se află la suprafață . În plus, lipaza are două . Unul este îngropat în fiecare subunitate monomerică. Ionul de calciu este esențial pentru plierea proteinelor și activitatea enzimatică ., Imaginea prezinta verde de ioni de calciu în subunitatea A, coordonat de Glu187, Arg190, Asp192, și Asp195 reziduuri. Încărcarea Ca (+2) este stabilizată de reziduurile de glutamat și aspartat încărcate negativ și de atomii de oxigen din două molecule de apă (roz). în plus, lipaza are un unic (verde) care blochează intrarea solventului în situsul activ (roșu). Capacul este o structură elicoidală de 25 de reziduuri care protejează gaura de oxianion., Capacul (galben) este deosebit de important să substrat obligatoriu ca acesta trece printr-o schimbare dramatică care modifică structura secundară a lipazei obligatoriu site-ul de la un (ul activ în roșu) la o (ul activ în albastru, triacylglyceride în spacefill) (a se vedea Lipaza capac transforma pentru o animație de tranziție). Deschiderea capacului este însoțită de o schimbare a structurii secundare de la o confirmare extinsă în cea mai mare parte beta la o structură în care mai mult de jumătate din situsul activ este format din helici alfa .,
coenzima Colipazei
lipaza este activată de colipază, o coenzimă care se leagă de domeniul C-terminal, necatalitic al lipazei. Colipaza este o proteină de 10kda care este secretată de pancreas într-o formă inactivă. Are cinci conservate (prezentate în galben) , și 2 – o suprafață hidrofilă (site-ul lipazei c – interacțiune terminală – prezentat în albastru) și o suprafață hidrofobă (conține mai multe bucle hidrofobe pentru a lega lipida-prezentată în alb). Tripsina va activa apoi colipaza înainte ca cofactorul să poată interacționa cu lipaza., Colipaza trebuie să fie prezentă pentru activarea lipazei și acționează ca o punte între lipază și lipidă. Când colipaza se leagă, lipaza activă este stabilizată pentru interacțiunea hidrofobă cu triacilgliceridele . Fără colipază prezentă, acumularea de amfifili la interfața ulei / apă în duoden ar împiedica lipaza pancreatică să se lege de substratul său. . Colipaza și lipaza sunt opuse locului activ de pe Terminalul C (contactele sunt regiuni de roz și galben, cu molecule de apă prezentate în albastru mai închis). De asemenea , este important să se ia în considerare și modul în care se utilizează .,
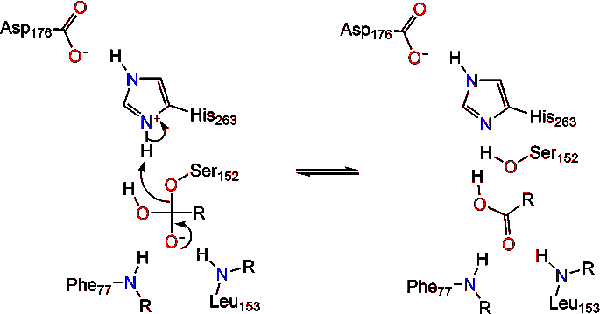
în prezența colipazei, enzima este activată care mișcă (prezentat în roșu, situsul activ în verde) care este compus din aminoacizi 216-239. Clapeta n-terminal se mișcă într-o manieră concertată împreună cu domeniul C-terminal pentru a dezvălui site-ul activ (verde), permițându-i să se lege cu un substrat. Se presupune că această flexibilitate poate avea o semnificație în legarea complexului colipază-lipază cu interfața apă-lipidă. Reorganizarea clapetei induce, de asemenea, o a doua schimbare conformațională care creează gaura oxianion.,activarea lipazei la interfața lipid-apă a triacilgliceridelor, în prezența colipazei și a sărurilor biliare, este cunoscută sub numele de activare interfacială. Pentru ca reacția de hidroliză să aibă loc, colipaza ancorează lipaza la membrana lipid-apă a micelului, ceea ce determină o schimbare de suprafață a lipazei. Cele patru bucle hidrofobe ale colipazei interacționează cu atmosfera hidrofobă a triacilgliceridei. Aceasta inițiază legarea site-ului activ la lipide și deschiderea capacului pentru a dezvălui un mediu mai hidrofob pentru triacilglicerol., Aceasta, la rândul său, permite triacilglicerolului să interacționeze cu reziduurile cheie ale site-ului activ, cum ar fi triada catalitică. O gamă diversă de enzime lipază pot fi găsite în natură. Deși diferite forme ocupa diverse proteine schele, cele mai multe sunt construite pe o alfa/beta hidrolază ori și posedă o chimotripsina-cum ar fi format dintr-un reziduurile acide, un histidină, și o serină nucleofil. În cazul lipazei pancreatice de cal, triada catalitică este compusă din . Această triadă catalitică funcționează ca cele mai multe găsite în natură., În primul rând, acidul aspartic formează o legătură de hidrogen cu 263-ul său, crescând pKa-ul azotului de histidină imidazol. Acest lucru permite histidinei să acționeze ca o bază generală puternică și să deprotoneze Serina. Serina deprotonată poate servi apoi ca nucleofil și poate ataca carbonilul ester al unuia dintre acizii grași pe carbonii 1 sau 3 ai coloanei vertebrale glicerol a substratului lipidic. La atacarea lipidelor, se formează un intermediar tetraedric încărcat negativ (reacția 1). Este stabilizat în gaura oxianion de două reziduuri: .,
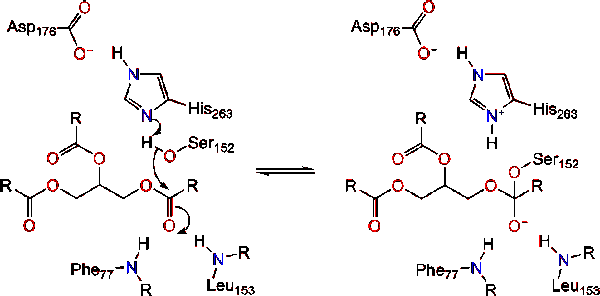
reformele carbonil cu segmentul glicerol coloana vertebrală acționează ca grupul de plecare (reacția 2).
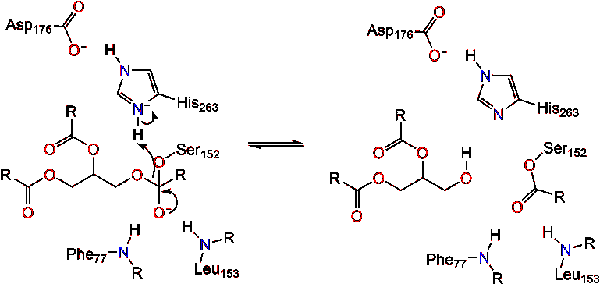
o moleculă de apă donează apoi un proton histidinei, creând un anion hidroxil reactiv. Anionul hidroxil poate ataca apoi carbonul carbonil al lipidei, formând un alt intermediar tetraedric încărcat negativ, care este stabilizat în gaura oxianion (reacția 3).,
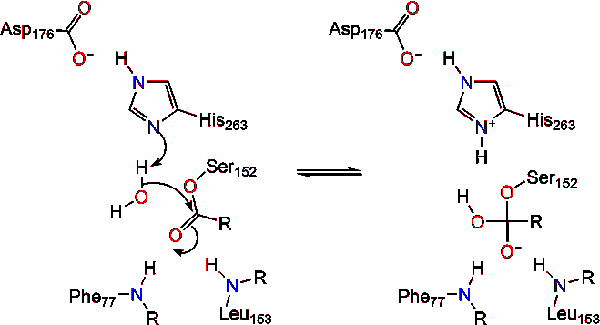
La reformarea carbonil, catalitic serina este eliberat și monogliceridă și acizi grași monomeri difuze departe (Reacția 4).
inhibarea lipazei pancreatice
(violet), un fosfonat de alchil C11, este un inhibitor competitiv al lipazei pancreatice. Se leagă direct în buzunarul site-ului activ. Există, de asemenea, cinci molecule de B-octilglucozid (gri și roșu) care se asociază cu lipaza., MUP formează legături de hidrogen cu: Ser 152 și His 263, care fac parte din triada catalitică, și Phe 77 și Leu 153, care sunt reziduurile Stabilizatoare situate în gaura oxianion .MUP s-a dovedit a fi prin contactele van der Waals cu lanțurile laterale hidrofobe Ala 178, Phe 215, Pro l80, Tyr ll4, Leu 213 (prezentat în albastru).
interacțiuni proteină – substrat
lipaza se leagă cu numeroase contacte hidrofobe. După cum se vede aici, lipaza interacționează cu grupul alchil al linoleatului de colesteril printr-o ruptură hidrofobă în proteină., Această ruptură orientează molecula pentru a optimiza reacția de lipoliză.
prezentat în această scenă este lipaza din drojdie Candida rugosa cu două molecule de cholesteryl linoleate (gri). Reziduurile site-ului activ, inclusiv Ser152, Asp176, și His263 sunt prezentate în reprezentarea stick roșu. Lipaza poate găzdui două molecule lipidice datorită faptului că două subunități identice catalizează o reacție identică. O moleculă de lipază poate cataliza două reacții de lipoliză simultan.,
semnificația clinică
lipaza pancreatică este secretată în duoden prin sistemul duct al pancreasului. La un individ sănătos, este la o concentrație foarte scăzută în ser. Sub întreruperea extremă a funcției pancreatice, cum ar fi pancreatita sau cancerul pancreatic, pancreasul poate începe să se digere și să elibereze enzimele pancreatice, inclusiv lipaza pancreatică în ser. Prin urmare, măsurarea concentrației serice a lipazei pancreatice poate ajuta la diagnosticarea pancreatitei acute.., Datorită activității lipazei în digestia și absorbția grăsimilor, a existat o piață în creștere pentru inhibitorii lipazei pentru produsele farmaceutice de scădere în greutate. Cel mai popular este Orlistat (sau Xenical®), care este un produs natural din Streptomyces toxytricini și este hidrogenarea produs de lipostation – o ireversibile inhibitor al lipazei. Acest inhibitor acționează și prin legarea Serului152, producând un ester care hidrolizează atât de lent încât este practic ireversibil .
structurile 3D ale lipazei
structurile 3D ale lipazei