structurile foarte organizate ale proteinelor sunt cu adevărat capodopere ale arhitecturii chimice. Dar structurile foarte organizate tind să aibă o anumită delicatețe, iar acest lucru este valabil și pentru proteine. Denaturarea este termenul folosit pentru orice modificare a structurii tridimensionale a unei proteine care o face incapabilă să-și îndeplinească funcția atribuită. O proteină denaturată nu își poate face treaba. (Uneori denaturarea este echivalată cu precipitarea sau coagularea unei proteine; definiția noastră este puțin mai largă.,) O mare varietate de reactivi și condiții, cum ar fi căldura, compușii organici, modificările pH-ului și ionii de metale grele pot provoca denaturarea proteinelor.
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
Utilizarea de compuși organici, cum ar fi alcool etilic |
Acești compuși sunt capabili de a se angaja în intermoleculare legaturilor de hidrogen cu moleculele de proteine, perturbarea legături de hidrogen intramoleculare în proteine., |
|
Săruri de ioni de metale grele, cum ar fi mercur, argint, plumb |
Acești ioni formează legături puternice cu anioni carboxilat de acid amino-acizi sau gruparile SH ale cisteinei, perturbarea legături ionice și legături disulfurice. |
|
Alcaloid reactivi, cum ar fi acidul tanic (utilizat în piele de bronzare) |
Acești reactivi se combină cu încărcat pozitiv grupările amino din proteine pentru a perturba legături ionice., |
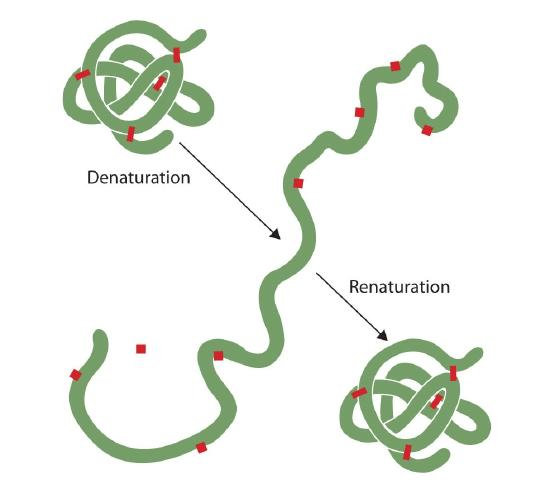
Oricine care a prajit un ou a observat denaturare. Albul de ou limpede devine opac pe măsură ce albumina denaturează și coagulează. Nimeni nu a inversat încă acest proces. Cu toate acestea, având în vedere circumstanțele adecvate și timpul suficient, o proteină care s-a desfășurat în condiții suficient de blânde se poate reface și poate prezenta din nou activitate biologică (figura 2.5.1). Astfel de dovezi sugerează că, cel puțin pentru aceste proteine, structura primară determină structura secundară și terțiară., O secvență dată de aminoacizi pare să adopte aranjamentul său tridimensional (3D) în mod natural, dacă condițiile sunt corecte.
structurile primare ale proteinelor sunt destul de robuste., În general, sunt necesare condiții destul de viguroase pentru hidrolizarea legăturilor peptidice. La nivel secundar prin niveluri cuaternare, totuși, proteinele sunt destul de vulnerabile la atac, deși variază în vulnerabilitatea lor la denaturare. Proteinele globulare pliate delicat sunt mult mai ușor de denaturat decât proteinele dure, fibroase ale părului și pielii.proteinele pot fi împărțite în două categorii: fibroase, care tind să fie insolubile în apă și globulare, care sunt mai solubile în apă. O proteină poate avea până la patru niveluri de structură., Structura primară constă în secvența specifică de aminoacizi. Lanțul peptidic rezultat poate forma o foaie α-helix sau β-plisată (sau structuri locale care nu sunt la fel de ușor clasificate), cunoscută sub numele de structură secundară. Aceste segmente de structură secundară sunt încorporate în structura terțiară a lanțului polipeptidic pliat. Structura cuaternară descrie aranjamentele subunităților într-o proteină care conține mai mult de o subunitate., Patru tipuri majore de interacțiuni atractive determină forma și stabilitatea proteinei pliate: legătura ionică, legătura de hidrogen, legăturile disulfidice și forțele de dispersie. O mare varietate de reactivi și condiții pot determina o proteină să se desfășoare sau să denatureze.