Pyridinium chlorochromate (PCC) is a milder version of chromic acid.
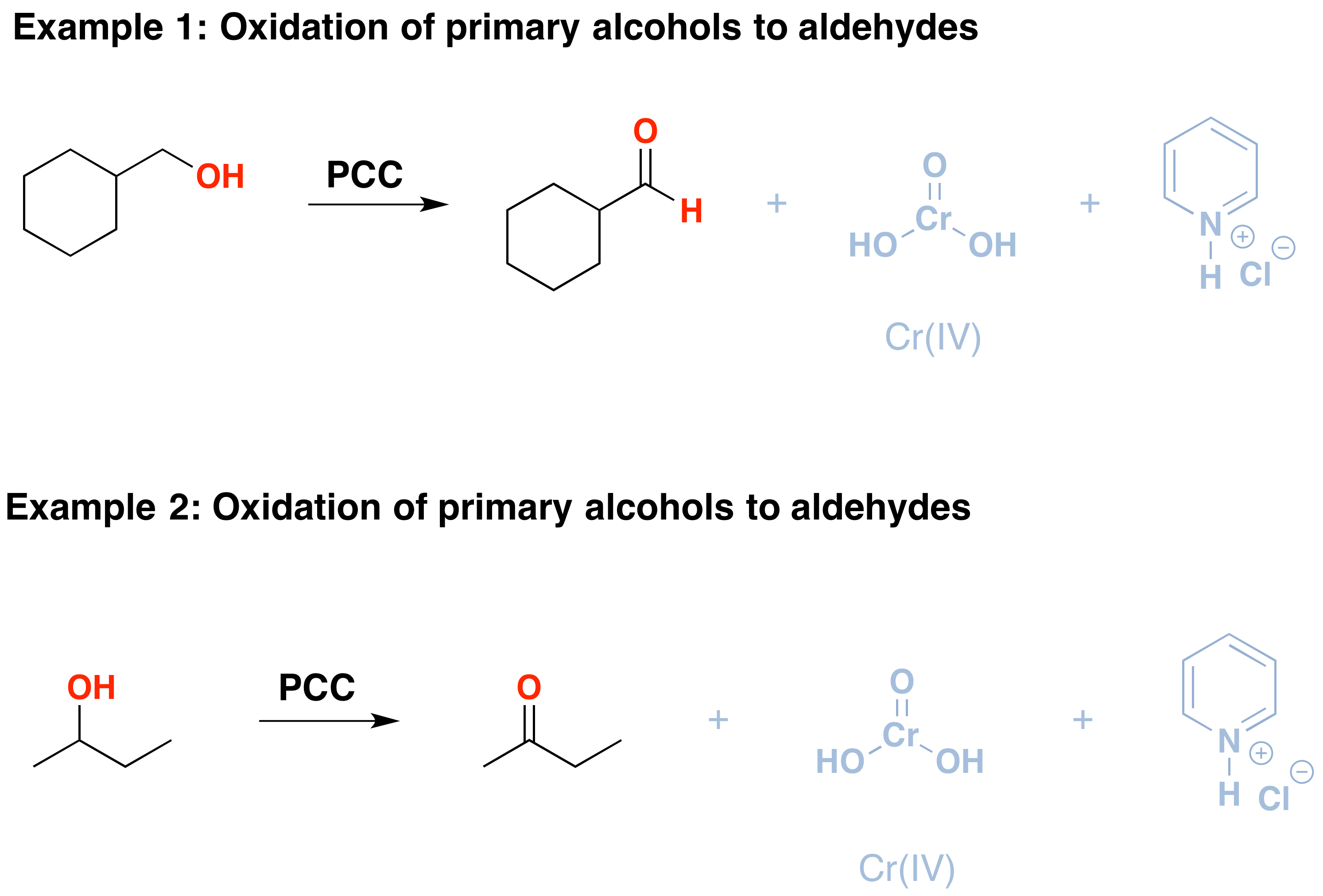
PCC oxidizes alcohols one rung up the oxidation ladder, from primary alcohols to aldehydes and from secondary alcohols to ketones. In contrast to chromic acid, PCC will not oxidize aldehydes to carboxylic acids., Similar ou o mesmo que: \(CrO_3\) e piridina (reagente de Collins) também oxida álcoois primários a aldeídos. Aqui estão dois exemplos de PCC em ação.
- se adicionar um equivalente de PCC a qualquer destes álcoois, será produzida a versão oxidada. Os subprodutos (caracterizados em cinza) são Cr(IV), bem como cloridrato de piridínio.
- deve-se ter cuidado com a quantidade de água presente na reacção., Se a água está presente, ela pode adicionar ao aldeído para criar o hidrato, que pode ser oxidado por um segundo equivalente de PCC se estiver presente. Esta não é uma preocupação com cetonas, porque não há H diretamente ligados C.
Como funciona? Reações de oxidação deste tipo são na verdade um tipo de reação de eliminação. A reação começa com uma única ligação carbono-oxigênio e resulta em uma dupla ligação carbono-oxigênio., A reação de eliminação pode ocorrer por causa do bom grupo de saída no oxigênio, ou seja, o crómio, que será deslocado quando a ligação C-H vizinha é quebrada com uma base.
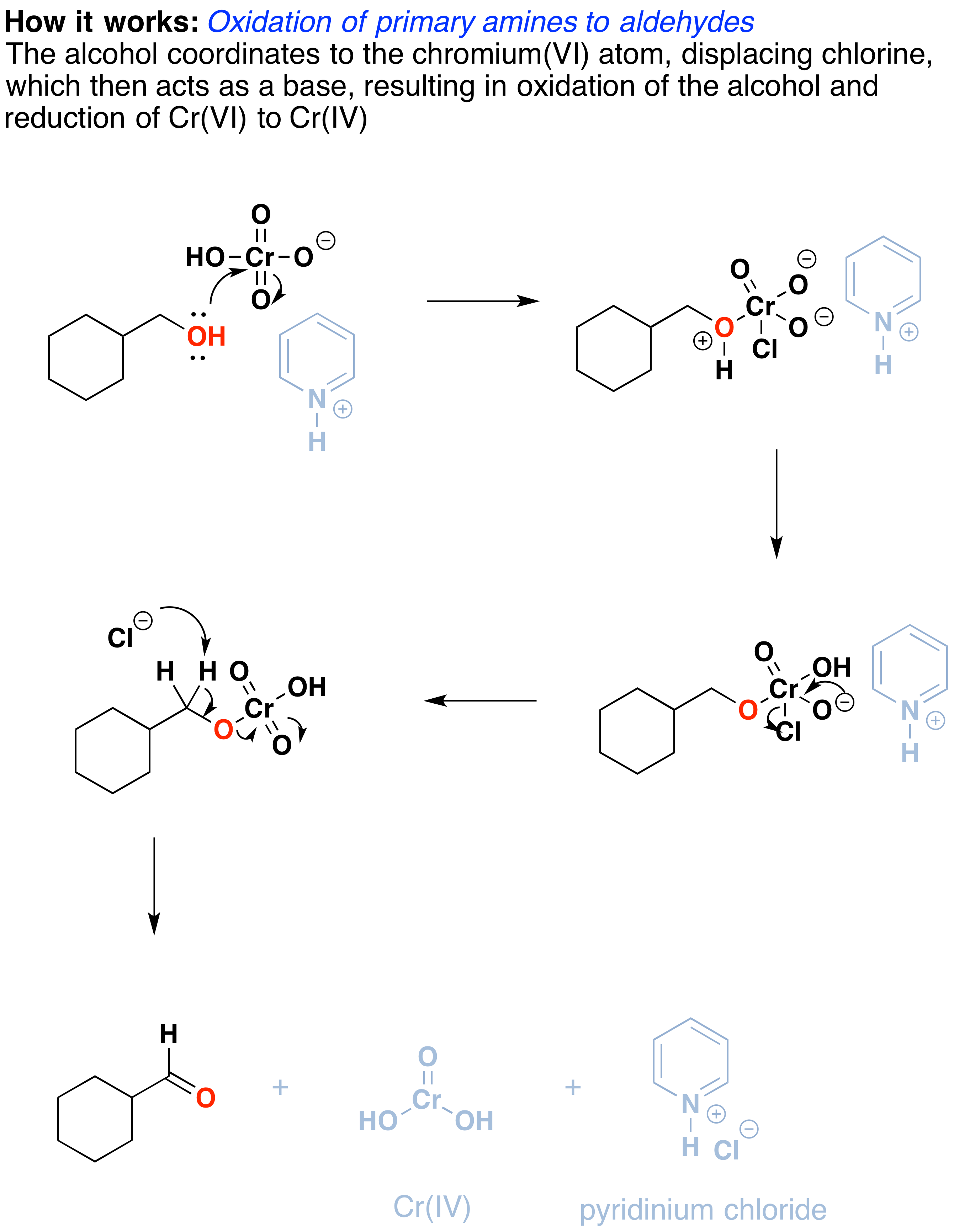
o primeiro passo é o ataque de oxigénio ao crómio para formar a ligação Cr-O. Em segundo lugar, um próton sobre o (agora positivo) OH é transferido para um dos oxígenos do crómio, possivelmente através da intermediação do sal piridínio., Um íon cloreto é então deslocado em uma reação reminiscente de uma reação de eliminação 1,2 para formar o que é conhecido como um éster cromato.
a ligação dupla C-O é formada quando uma base remove o próton no carbono adjacente ao oxigênio. Os elétrons da ligação C-H movem-se para formar a ligação C-O, e no processo, a ligação O-Cr é quebrada, E Cr(VI) torna-se Cr(IV) (desenhado aqui como o=Cr(OH)2 ).,
vida Real notas: Se você acabar usando PCC no laboratório, não se esqueça de adicionar peneiras moleculares ou Celite ou algum outro sólido para a parte inferior do balão, porque caso contrário, você obtém uma desagradável marrom alcatrão, que é difícil de limpar. A toxicidade e confusão associada ao crómio estimulou o desenvolvimento de outras alternativas, tais como TPAP, IBX, DMP, e uma série de outros reagentes sobre os quais normalmente não se aprende até a graduação.
Contribuintes
-
James Ashenhurst (MasterOrganicChemistry.com)