introdução
Lipase catalisa a degradação dos lípidos por hidrolisação dos ésteres dos ácidos gordos. Sua função é importante para a digestão e promover a absorção de gorduras nos intestinos. A Lipase é encontrada principalmente no pâncreas e secretada, mas também na saliva e estômago.
- lipase pancreática (PDB ID: 1hpl) que é retratada à direita, é uma hidrolase de éster carboxílico. É também comumente chamado de triacilglicerol pancreático lipase e seu número de classe enzimática é E. C. 3.1.1.3 .,a lipase estimulada pelo sal biliar (BSSL) é encontrada no leite materno.
- a lipase hormonal sensível (LIPE) hidrolisa uma variedade de ésteres. Para mais pormenores, ver lipase sensível às hormonas.Monoacilglicerol lipase (MAGL) hidrolisa triglicéridos intracelulares para ácidos gordos e glicerol. MAGL funciona junto com LIPE. Para mais pormenores, ver Monoglicerida lipase.
a reacção catalisada pela enzima é mostrada abaixo.
iscriminação adicional resulta, em última análise, em 2-monoacilgliceróis e ácidos gordos livres ., Uma profunda discussão do mecanismo pode ser encontrada na seção do mecanismo catalítico da Lipase. A determinação da estrutura e função da lipase foi um processo gradual. A actividade da Lipase foi demonstrada pela primeira vez no pâncreas por Claude Bernard em 1846. No entanto, foi apenas em 1955 que Mattson e Beck demonstraram uma alta especificidade da lipase pancreática para ésteres primários de triglicéridos . Nos últimos anos, a determinação da estrutura cristalina da lipase pancreática tornou-se o foco principal, uma vez que muitos cientistas têm trabalhado para promover isso.,
Veja também:
- Molecular Playground/Lipase Pancreática
- Lipase tampa morph
- Hormônio sensível lipase
- Lipase de Candida antarctica no estado fechado
- Monoglyceride lipase
- Humanos lipase gástrica
- Lipase (hebraico)
- o metabolismo Lipídico
Estrutura
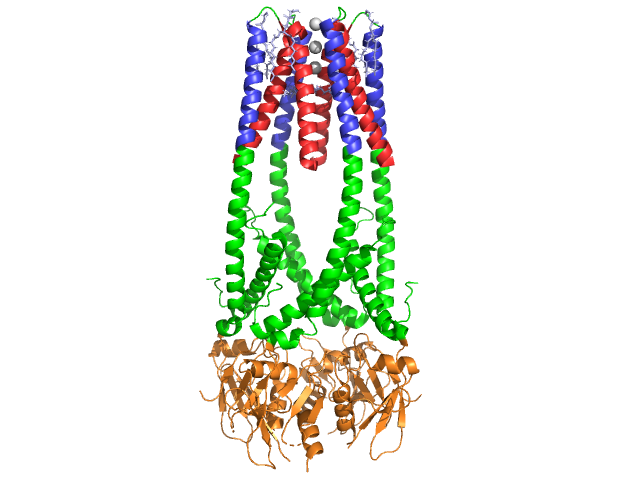
a lipase Pancreática é uma proteína de 50 kDa., Enquanto a unidade assimétrica cristalográfica contém duas cadeias idênticas, a informação (observação 350) no arquivo de dados 1hpl indica que o dímero é um artefato de cristalização, e que a forma funcional (também chamada de conjunto biológico) é uma cadeia única (monômero). A cadeia é constituída por 449 resíduos . O s da lipase (em uma subunidade) inclui 102 resíduos que criam 13 hélices Alfa, mostradas em vermelho, e 139 resíduos envolvidos em folhas beta totalizando 28 fios, mostrados em ouro. As hélices Alfa representam 22% da proteína, enquanto as folhas beta representam 30%., Cada cadeia contém duas bem definidas . O domínio terminal N, mostrado em azul, é caracterizado por uma dobra alfa / beta hidrolase. Enquanto o domínio terminal C, mostrado em verde, contém um sanduíche de folha beta que interage com colipase . Cada monômero e estrutura dímero da lipase são mantidos juntos por ligações dissulfeto, ligações de hidrogênio e interações eletrostáticas (pontes Salinas). A Lipase tem um total de 12 resíduos de cisteína. são formados entre os nitrogênios de carga positiva (azul) em Arg e Lys, e oxígenos negativos (vermelho) em Asp e resíduos de Glu., (em amarelo) também estabiliza a enzima entre a cadeia principal e os átomos da cadeia lateral. Lipase tem uma distribuição distinta de resíduos (purple spacefill representa resíduos polares). O colapso hidrofóbico contribui para grande parte das estruturas secundárias e terciárias, como o (mostrado em branco) compõem o interior da proteína, enquanto os resíduos polares (azul transparente) estão na superfície . Além disso, lipase tem dois . Um é enterrado em cada subunidade monomérica. O ião cálcio é essencial para a dobragem proteica e atividade enzimática ., A imagem mostra o íon de cálcio verde na subunidade A, coordenado por resíduos de Glu187, Arg190, Asp192 e Asp195. A carga Ca (+2) é estabilizada por resíduos de glutamato e aspartato carregados negativamente, e os átomos de oxigênio de duas moléculas de água (rosa).
além disso, a lipase tem um único (verde) que impede o solvente de entrar no local activo (vermelho). A tampa é uma estrutura helicoidal de 25 resíduos que protege o buraco oxianion., A tampa (amarela) é especialmente importante para a ligação do substrato, uma vez que sofre uma mudança dramática que altera a estrutura secundária do local de ligação da lipase de um (local ativo em vermelho) para um (local ativo em azul, triacilglicerida no spacefill) (ver lipase lid morph para uma animação desta transição). A abertura da tampa é acompanhada por uma mudança na estrutura secundária de uma confirmação beta-estendida principalmente para uma estrutura onde mais de metade do local ativo é formado a partir de hélices Alfa .,
Colipase coenzima
Lipase é activada pela colipase, uma coenzima que se liga ao Domínio C-terminal, não catalítico da lipase. A Colipase é uma proteína de 10kDa secretada pelo pâncreas numa forma inactiva. Tem cinco conservadas (mostradas em amarelo) , e 2 – uma superfície hidrofílica (local da lipase C-interação terminal – mostrado em azul) e uma superfície hidrofóbica (contém múltiplos loops hidrofóbicos para superar o lipídico – mostrado em branco). Tripsin irá então ativar colipase antes que o cofactor possa interagir com lipase.,
Colipase deve estar presente para a ativação da lipase e atua como uma ponte entre a lipase e os lípidos. Quando a colipase se liga, a lipase activa é estabilizada para a interacção hidrofóbica com triacilglicéridos . Sem a presença de colipase, a acumulação de anfifiles na interface óleo/água do duodeno impediria a lipase pancreática de se ligar ao seu substrato. . Colipase e lipase são opostas do local ativo no terminal-C (contatos são regiões de rosa e amarelo, com moléculas de água mostradas em azul escuro). As enzimas estão ligadas por interações polares como, e .,
na presença de colipase, a enzima é activada, o que move o (mostrado em vermelho, local activo em verde) que é composto por aminoácidos 216-239. A aba N-terminal move-se de forma concertada, juntamente com o domínio C-terminal para revelar o local ativo (verde), permitindo-lhe se ligar com um substrato. Existe a hipótese de que esta flexibilidade pode ter significado na ligação do complexo colipase-lipase com a interface água-lipídico. A reorganização do flap também induz uma segunda mudança conformacional que cria o buraco de oxianião.,
mecanismo catalítico de Lipase
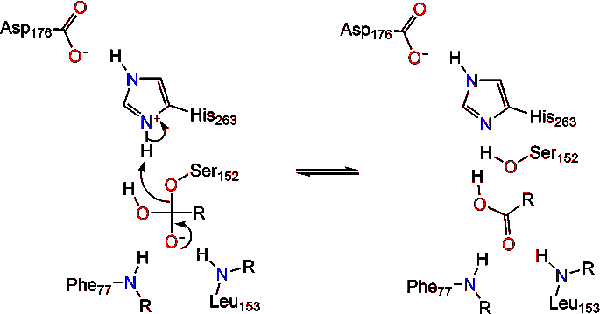
ativação Lipase na interface lípido-água de triacilglicéridos, na presença de sais de colipase e bílis, é conhecida como ativação interfacial. Para a reação de hydroloysis ocorrer, a colipase anchora a lipase para a membrana lipídica-água da micela, que causa uma mudança de superfície na lipase. Os quatro laços hidrofóbicos de Colipase interagem com a atmosfera hidrofóbica do triacilglicerido. Isto inicia a ligação activa do local ao lípido, e a abertura da tampa para revelar um ambiente mais hidrofóbico para o triacilglicerol., Isto, por sua vez, permite que o triacilglicerol interaja com os principais resíduos ativos do local, como a tríade catalítica. Uma variedade diversa de enzimas lipase pode ser encontrada na natureza. Embora as diferentes formas ocupem diferentes Andaimes proteicos, a maioria é construída sobre uma dobra de hidrolase alfa/beta e possui uma quimotripsina composta por um resíduo ácido, uma histidina e um nucleófilo Serino. No caso da lipase pancreática do Cavalo, A Tríade catalítica é composta por . Esta tríade catalítica funciona como a maioria encontrada na natureza., Primeiro, o ácido aspártico forma uma ligação de hidrogênio com seus 263, aumentando o pKa do nitrogênio histidina imidazole. Isto permite que o histidina aja como uma poderosa base geral e desprotone o Serino. A serina desprotonada então pode servir como um nucleófilo e atacar o éster carbonil de um dos ácidos graxos no 1 ou 3 carbonos da espinha dorsal do glicerol do substrato lipídico. Ao atacar o lípido, um intermediário tetraédrico carregado negativamente é formado (reação 1). É estabilizada no buraco oxianion por dois resíduos:.,
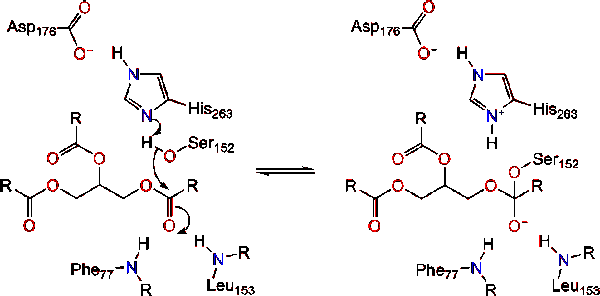
as reformas carbonil com o segmento da coluna vertebral do glicerol atuando como o grupo de saída (reação 2).
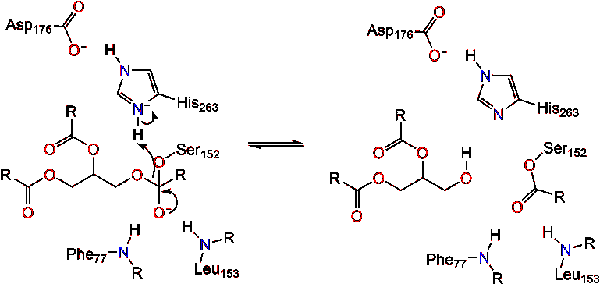
uma molécula de água doa um próton à histidina, criando um anião hidroxila reactivo. O anião hidroxila pode então atacar o carbono carbonilo do lípido, formando outro intermediário tetraédrico carregado negativamente que é estabilizado no buraco oxianion (reação 3).,
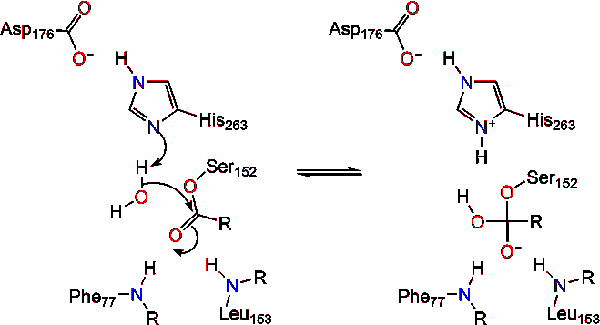
após a reforma do carbonilo, a serina catalítica é libertada e os monómeros de monoglicérido e de ácidos gordos difundiram-se (reacção 4).
a Inibição da Lipase Pancreática
(roxo), um C11 alquil phosphonate, é um inibidor competitivo da lipase pancreática. Liga-se directamente no bolso activo do local. Existem também cinco moléculas B-octilglucosido (cinza e vermelho) que se associam à lipase., MUP forma ligações de hidrogênio com: Ser 152 e seu 263, que fazem parte da tríade catalítica, e Phe 77 e Leu 153, que são os resíduos estabilizantes localizados no buraco oxianion .MUP foi mostrado para ser por Van der Waals contatos com cadeias laterais hidrofóbicas Ala 178, Phe 215, Pro l80, Tyr ll4, Leu 213 (mostrado em azul).a Lipase liga-se com numerosos contactos hidrofóbicos. Como é visto aqui, a lipase interage com o grupo alquilo do linoleato de colesterilo através de uma fenda hidrofóbica dentro da proteína., Esta fenda orienta a molécula para optimizar a reacção de lipólise.
mostrado nesta cena é lipase da Candida rugosa levedura com duas moléculas de linoleato de colesterilo (cinza). Os resíduos ativos do local, incluindo Ser152, Asp176 e His263, são mostrados na representação de vara vermelha. Lipase pode acomodar duas moléculas lipídicas devido ao fato de que são duas subunidades idênticas catalisar uma reação idêntica. Uma molécula de lipase pode catalisar duas reações de lipólise de cada vez., a lipase pancreática é secretada no duodeno através do sistema de ducto do pâncreas. Num indivíduo saudável, encontra-se numa concentração sérica muito baixa. Sob uma perturbação extrema da função pancreática, como pancreatite ou cancro pancreático, o pâncreas pode começar a digerir-se e a libertar enzimas pancreáticas, incluindo a lipase pancreática no soro. A medição da concentração sérica da lipase pancreática pode, portanto, ajudar no diagnóstico da pancreatite aguda.., Devido à actividade da lipase na digestão e absorção de gordura, tem havido um mercado crescente de inibidores da lipase para produtos farmacêuticos para perda de peso. O mais popular é o orlistato (ou Xenical®), que é um produto natural de Streptomyces toxytricini e é o produto da hidrogenação da lipostação – um inibidor irreversível da lipase. Este inibidor também actua ligando Ser152, produzindo um éster que hidrolisa tão lentamente que é praticamente irreversível .
estruturas 3D da Lipase
estruturas 3D da Lipase