as estruturas altamente organizadas de proteínas são verdadeiramente obras-primas da arquitetura química. Mas estruturas altamente organizadas tendem a ter uma certa delicadeza, e isso é verdade para as proteínas. Desnaturação é o termo usado para qualquer mudança na estrutura tridimensional de uma proteína que a torna incapaz de executar sua função atribuída. Uma proteína desnaturada não pode fazer o seu trabalho. (Às vezes a desnaturação é igualada com a precipitação ou coagulação de uma proteína; nossa definição é um pouco mais ampla.,) Uma grande variedade de reagentes e Condições, tais como calor, compostos orgânicos, mudanças de pH, e íons de metais pesados podem causar desnaturação de proteínas.
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
o Uso de compostos orgânicos, tais como álcool etílico |
Estes compostos são capazes de se engajar em intermoleculares ligação de hidrogênio com moléculas de proteínas, atrapalhando o intramolecular de hidrogénio ligação no interior da proteína., |
|
Sais de íons de metais pesados, como o mercúrio, prata e chumbo |
Esses íons formar laços fortes com o carboxilato de etilo ânions dos ácidos amino ácidos ou grupos SH da cisteína, interrompendo iônica obrigações e bissulfeto de ligações. |
|
Alcalóide reagentes, como o ácido tânico (usado no curtimento do couro) |
Estes reagentes combinar com carga positiva dos grupos de aminoácidos em proteínas para interromper iônica títulos., |
qualquer pessoa que tenha fritado um ovo observou desnaturação. A clara branca de ovo torna-se opaca à medida que a albumina denuncia e coagular. Ainda ninguém inverteu esse processo. No entanto, dadas as circunstâncias adequadas e o tempo suficiente, uma proteína que se desdobrou em condições suficientemente suaves pode voltar a ser alimentada e voltar a apresentar actividade biológica (figura 2.5.1). Tal evidência sugere que, pelo menos para estas proteínas, a estrutura primária determina a estrutura secundária e terciária., Uma dada sequência de aminoácidos parece adotar o seu arranjo tridimensional particular (3D) naturalmente, se as condições estiverem corretas.
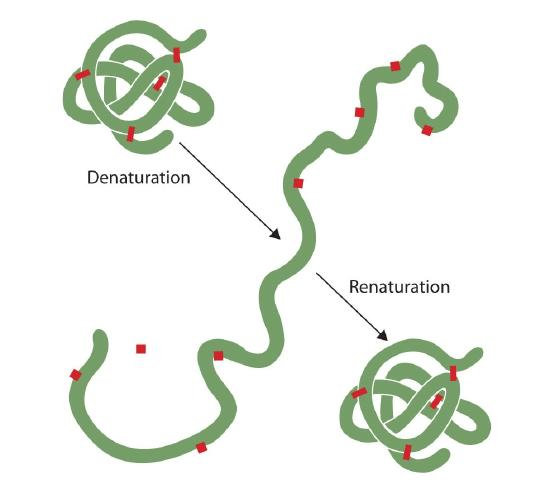
as estruturas primárias das proteínas são bastante resistentes., Em geral, condições bastante vigorosas são necessárias para hidrolizar ligações peptídicas. No nível secundário através do Quaternário, no entanto, as proteínas são bastante vulneráveis ao ataque, embora variem em sua vulnerabilidade à desnaturação. As proteínas globulares delicadamente dobradas são muito mais fáceis de desnaturar do que as proteínas duras e fibrosas do cabelo e da pele.
resumo
proteínas podem ser divididas em duas categorias: fibrosas, que tendem a ser insolúveis em água, e globulares, que são mais solúveis em água. Uma proteína pode ter até quatro níveis de estrutura., A estrutura primária consiste na sequência específica de aminoácidos. A cadeia peptídica resultante pode formar uma folha de α-hélice ou β-pleated (ou estruturas locais não tão facilmente categorizadas), que é conhecida como estrutura secundária. Estes segmentos de estrutura secundária são incorporados na estrutura terciária da cadeia polipeptídica dobrada. A estrutura quaternária descreve os arranjos de subunidades em uma proteína que contém mais de uma subunidade., Quatro grandes tipos de interações atrativas determinam a forma e estabilidade da proteína dobrada: ligação iônica, ligação de hidrogênio, ligações dissulfeto e forças de dispersão. Uma grande variedade de reagentes e condições pode causar uma proteína para desdobrar ou desnaturar.