struktura Lewisa cząsteczki wody zawiera dwa pojedyncze wiązania wokół atomu tlenu. liczba całkowitych elektronów walencyjnych atomów tlenu i wodoru służy do rysowania struktury Lewisa. Każdy etap rysowania struktury H2O jest wyjaśniony w tym tutorialu.
H2O struktura Lewisa
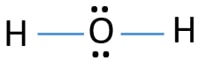
w strukturze Lewisa H2O istnieją dwa pojedyncze wiązania wokół atomu tlenu. Atomy wodoru łączą się z atomami tlenu poprzez pojedyncze wiązania. Ponadto na atomie tlenu występują dwie samotne pary.,
cząsteczka wody jest prostą cząsteczką. Rysowanie struktury cząsteczki wody jest proste niż niektóre z innych złożonych cząsteczek lub jonów. Wyobraź sobie rysowanie struktury Lewisa jonu tiosiarczanu.
kroki rysowania struktury Lewisa H2O
aby prawidłowo narysować strukturę Lewisa należy wykonać kilka kroków. Dla cząsteczki H2O, jej struktura lewis i te kroki są szczegółowo wyjaśnione w tym tutorialu. Ponieważ cząsteczka wody jest prosta, niektóre z tych kroków nie są używane zbyt często. W takich przypadkach są one wymienione z odpowiednimi krokami.,
- Znajdź całkowitą liczbę elektronów powłok walankowych atomów wodoru i atomu tlenu
- całkowite pary elektronów Jako samotne pary i wiązania
- wybór atomu Centrum
- zaznacz samotne pary na atomach
- zaznacz ładunki na atomach, jeśli istnieją.
- Sprawdź stabilność i zminimalizuj ładunki na atomach, przekształcając pojedyncze pary w wiązania, aby uzyskać najlepszą strukturę Lewisa.
ważne: rysowanie poprawnej struktury Lewisa jest ważne, aby prawidłowo rysować struktury rezonansowe.,
całkowita liczba elektronów powłoki walankowej H2O
istnieją dwa pierwiastki; wodór i tlen. Wodór jest elementem grupy IA i ma tylko jeden elektron w swojej ostatniej powłoce (powłoce walencyjnej). Tlen jest grupą poprzez pierwiastek w układzie okresowym i zawiera sześć elektronów w swojej ostatniej powłoce. Teraz wiemy, ile elektronów zawiera się w powłokach walencyjnych każdego atomu.,
- elektrony walencyjne podane przez atomy wodoru = 1 * 2 = 2
- elektrony walencyjne podane przez atomy tlenu = 6*1 = 6
- elektrony walencyjne ogółem = 2 + 6 = 8
pary elektronów walencyjnych ogółem
pary elektronów walencyjnych ogółem = σ wiązania + π wiązania + pary samotnych w powłokach walencyjnych
całkowite pary elektronów określa się przez podzielenie liczby całkowitych elektronów walencyjnych przez dwa. Dla H2O, suma par elektronów jest 4 w ich skorupach walencyjnych.,
Atom Centrum H2O
aby być atomem centrum, ważna jest zdolność do posiadania większej walancji. Więc, z wodoru i tlenu, który atom ma najwyższą Walencję? Maksymalna wartość tlenu wynosi 2. Wodór ma tylko jedną wartość. Dlatego atom tlenu powinien być centralnym atomem H2O. teraz możemy narysować szkic H2O, aby pokazać, jak atomy znajdują się w cząsteczce.
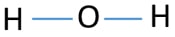
samotne pary na atomach
po określeniu atomu środkowego i szkicu cząsteczki H2O powinniśmy zacząć oznaczać samotne pary na atomach., Pamiętaj, że w sumie są cztery pary elektronów.
- w rysowanej strukturze szkicu są już dwa wiązania H-O. Teraz tylko dwie (4-2) pary elektronów pozostają do oznaczenia na atomach.
- Zwykle te pozostałe pary elektronów powinny być rozpoczynane do oznaczania na zewnętrznych atomach. Ale w H2O atom wodoru to zewnętrzne atomy, które nie mogą utrzymać więcej niż dwóch elektronów w swojej ostatniej powłoce. Dlatego nie możemy oznaczyć tych dwóch par elektronów na atomach wodoru.,
- następnie zaznacz te dwie pary elektronów na atomie centralnym; tlen

zaznacz ładunki na atomach
nie ma ładunków na atomie tlenu i atomach wodoru.
Sprawdź stabilność i zminimalizuj ładunki na atomach zamieniając pojedyncze pary na wiązania
ponieważ nie ma ładunków na atomach, nie ma potrzeby zmniejszania ładunków jako kroku rysowania najlepszej struktury Lewisa. Mamy już najlepszą strukturę Lewisa dla H2O.
Pytania
jakie są podobne struktury Lewisa do wody?,
w strukturze cząsteczki wody istnieją dwa wiązania sigma i dwie samotne pary wokół sulfuratomu. Siarkowodór, difluorek tlenu (F2O) mają podobne struktury do wody.
zadaj pytania z chemii i znajdź odpowiedzi
powiązane Poradniki