wprowadzenie
lipaza katalizuje rozpad lipidów poprzez hydrolizę estrów kwasów tłuszczowych. Jego funkcja jest ważna dla trawienia i promowania wchłaniania tłuszczów w jelitach. Lipaza znajduje się głównie w trzustce i jest wydzielana przez nią, ale znajduje się również w ślinie i żołądku.
- lipaza trzustkowa (PDB ID: 1HPL), która Na zdjęciu po prawej stronie, jest hydrolaz estru karboksylowego. Jest również powszechnie nazywany lipazą triacyloglicerolu trzustkowego, a jego numer klasy enzymu to E. C. 3.1.1.3 .,
- lipaza pobudzana solą żółciową (BSSL) znajduje się w mleku matki.
- lipaza wrażliwa na hormony (LIPE) hydrolizuje różne estry. Szczegóły patrz lipaza wrażliwa na hormony.
- lipaza Monoacyloglicerolowa (MAGL) hydrolizuje wewnątrzkomórkowe trójglicerydy do kwasów tłuszczowych i glicerolu. MAGL funkcjonuje razem z LIPE. Szczegóły patrz lipaza Monoglicerydowa.
reakcja katalizowana przez enzym jest pokazana poniżej.
dalszy podział ostatecznie prowadzi do powstania 2-monoacylogliceroli i wolnych kwasów tłuszczowych ., Szczegółowe omówienie mechanizmu można znaleźć w sekcji Mechanizm katalityczny lipazy. Określenie struktury i funkcji lipazy było procesem stopniowym. Aktywność lipazy została po raz pierwszy wykazana w trzustce przez Claude ' a Bernarda w 1846 roku. Jednak dopiero w 1955 roku Mattson i Beck wykazali wysoką swoistość lipazy trzustkowej dla pierwotnych estrów triglicerydów . W ostatnich latach determinacja struktury krystalicznej lipazy trzustkowej stała się głównym celem, ponieważ wielu naukowców pracowało nad tym.,
patrz też
- lipaza cząsteczkowa/trzustkowa
- lipaza lid
- lipaza z Candida antarctica w stanie zamkniętym
- lipaza Monoglicerydowa
- lipaza żołądkowa człowieka
- lipaza (hebrajska)
- metabolizm lipidów
lipaza wrażliwa na hormony
struktura
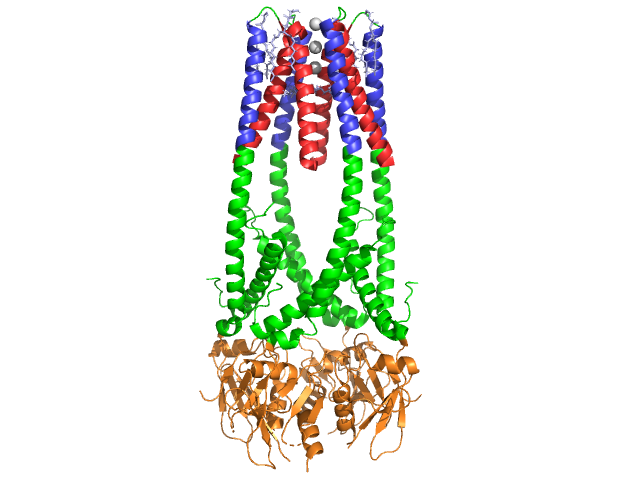
lipaza trzustkowa jest białkiem o masie 50 kDa., Podczas gdy krystalograficzna Jednostka asymetryczna zawiera dwa identyczne łańcuchy, informacja (Uwaga 350) w pliku danych 1hpl wskazuje, że dimer jest artefaktem krystalizacji, a forma funkcjonalna (zwana także zespołem biologicznym) jest pojedynczym łańcuchem (monomerem). Łańcuch składa się z 449 pozostałości . S lipazy (w jednej podjednostce) zawiera 102 pozostałości, które tworzą 13 helisy Alfa, pokazane na czerwono, i 139 pozostałości zaangażowanych w arkuszach beta łącznie 28 nici, pokazane na złocie. Helisy Alfa stanowią 22% białka, podczas gdy arkusze beta stanowią 30%., Każdy łańcuch zawiera dwa dobrze zdefiniowane . Domena końcowa N, pokazana na niebiesko, charakteryzuje się fałdem alfa / beta hydrolazy. Podczas gdy domena terminalna C, pokazana na Zielono, zawiera warstwę arkusza beta, która wchodzi w interakcję z kolipazą . Każda struktura monomeru i dimeru lipazy jest utrzymywana razem przez wiązania dwusiarczkowe, wiązania wodorowe i oddziaływania elektrostatyczne (mosty solne). Lipaza ma łącznie 12 reszt cysteiny. powstają między dodatnio naładowanymi nitrogenami (niebieskimi) w ARG i Lys, a ujemnymi tlenami (czerwonymi) w resztach Asp i Glu., (w Kolorze Żółtym) stabilizuje również enzym między atomami łańcucha głównego i łańcucha bocznego. Lipaza ma wyraźny rozkład pozostałości (purpurowa spacefill reprezentuje pozostałości polarne). Załamanie hydrofobowe przyczynia się do znacznej części struktur drugorzędowych i trzeciorzędowych, ponieważ (pokazane na biało) tworzą wnętrze białka, podczas gdy pozostałości polarne (przezroczysty Niebieski) znajdują się na powierzchni . Ponadto lipaza ma dwa . Jedna jest zakopana w każdej podjednostce monomeru. Jon wapnia jest niezbędny do fałdowania białek i aktywności enzymatycznej ., Zdjęcie przedstawia zielony jon wapnia w podjednostce A, koordynowany przez pozostałości Glu187, Arg190, Asp192 i Asp195. Ładunek Ca(+2) stabilizowany jest ujemnie naładowanymi resztami glutaminianu i asparaginianu oraz atomami tlenu z dwóch cząsteczek wody (różowej).
ponadto lipaza ma unikalny (zielony), który blokuje rozpuszczalnik przed dostaniem się do aktywnego miejsca (czerwony). Pokrywa jest 25-pozostałą strukturą spiralną, która chroni otwór oksyanionowy., Pokrywa (żółta) jest szczególnie ważna dla wiązania substratu, ponieważ ulega dramatycznemu przesunięciu, które zmienia drugorzędną strukturę miejsca wiązania lipazy z a (aktywne miejsce w kolorze czerwonym) do an (aktywne miejsce w Kolorze Niebieskim, triacylogliceryd w spacefill) (zobacz lipase lid morph dla animacji tego przejścia). Otworowi pokrywowemu towarzyszy zmiana struktury wtórnej z przeważnie beta-rozszerzonej na strukturę, w której ponad połowa aktywnego miejsca powstaje z Helis Alfa .,
koenzym Kolipazy
lipaza jest aktywowana przez koenzym, koenzym, który wiąże się z C-końcową, niekatalityczną domeną lipazy. Kolipaza jest białkiem 10kDa wydzielanym przez trzustkę w formie nieaktywnej. Ma pięć konserwowanych (pokazano na Żółto) , a 2 – hydrofilową powierzchnię (miejsce interakcji lipazy C-terminal – pokazano na niebiesko) i hydrofobową powierzchnię (zawiera wiele hydrofobowych pętli do mostkowania lipidów – pokazano na biało). Trypsyna aktywuje kolipazę, zanim kofaktor będzie mógł wchodzić w interakcje z lipazą.,
Kolipaza musi być obecna do aktywacji lipazy i działa jako pomost między lipazą a lipidem. Gdy kolipaza wiąże się, aktywna lipaza jest stabilizowana do hydrofobowej interakcji z triacyloglicerydami . Bez obecności kolipazy, gromadzenie się amfifilów na styku olej / woda w dwunastnicy zapobiegłoby wiązaniu lipazy trzustkowej z jej substratem. . Kolipaza i lipaza są przeciwne do aktywnego miejsca na terminalu C (styki to obszary różowe i żółte, z cząsteczkami wody pokazanymi w ciemniejszym kolorze niebieskim). Enzymy są związane oddziaływaniami polarnymi, takimi jak, oraz .,
w obecności kolipazy aktywuje się enzym, który przesuwa (pokazane na Czerwono, aktywne miejsce na Zielono), który składa się z aminokwasów 216-239. N-terminal płat porusza się w sposób uzgodniony wraz z C-terminal domeny ujawnić aktywne miejsce (zielony), umożliwiając mu związanie z substratem. Istnieje hipoteza, że ta elastyczność może mieć znaczenie w wiązaniu kompleksu kolipaza-lipaza z interfejsem woda-lipid. Reorganizacja klapy wywołuje również drugą zmianę konformacyjną, która tworzy otwór oksyanionowy.,
Mechanizm katalityczny lipazy
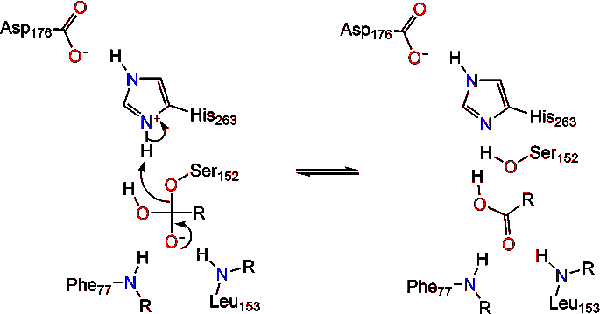
aktywacja lipazy na styku lipid-woda triacyloglicerydów, w obecności kolipazy i soli żółciowych, jest znana jako aktywacja międzyfazowa. W celu przeprowadzenia reakcji hydrolizy, kolipaza przyłącza lipazę do błony lipidowo-wodnej micella, co powoduje zmianę powierzchni lipazy. Cztery pętle hydrofobowe kolipazy oddziałują z hydrofobową atmosferą triacyloglicerydu. To inicjuje aktywne miejsce wiązania lipidów i otwarcie pokrywy, aby odsłonić bardziej hydrofobowe środowisko dla triacyloglicerolu., To z kolei pozwala triacyloglicerol wchodzić w interakcje z kluczowymi pozostałościami aktywnego miejsca, takimi jak Triada katalityczna. Różnorodne enzymy lipazy można znaleźć w przyrodzie. Chociaż różne formy zajmują różnorodne rusztowania białkowe, większość zbudowana jest na fałdzie alfa / beta hydrolazy i posiada chymotrypsynę podobną do niej, składającą się z kwaśnej pozostałości, histydyny i nukleofila serynowego. W przypadku lipazy trzustkowej koni składa się z triady katalitycznej . Ta katalityczna Triada działa jak większość występujących w przyrodzie., Po pierwsze, kwas asparaginowy tworzy wiązanie wodorowe z His 263, zwiększając PKA azotu histydyny imidazolu. To pozwala histydyna działać jako potężny ogólny podstawa i deprotonować serynę. Deprotonowana seryna może następnie służyć jako nukleofil i atakować karbonyl estru jednego z kwasów tłuszczowych na 1 lub 3 węgle szkieletu glicerolu substratu lipidowego. Po zaatakowaniu lipidów powstaje Ujemnie naładowany czworościenny związek pośredni (reakcja 1). Jest stabilizowany w otworze oksyanionowym przez dwie pozostałości: .,
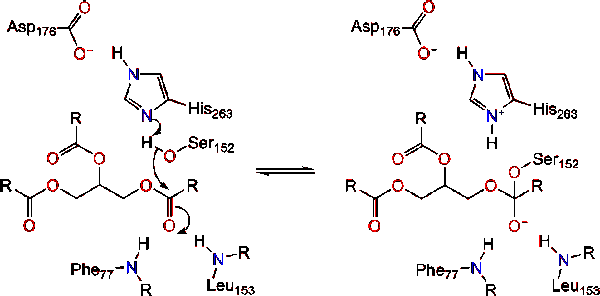
reform karbonylowych z segmentem szkieletowym glicerolu działającym jako grupa odchodząca (Reakcja 2).
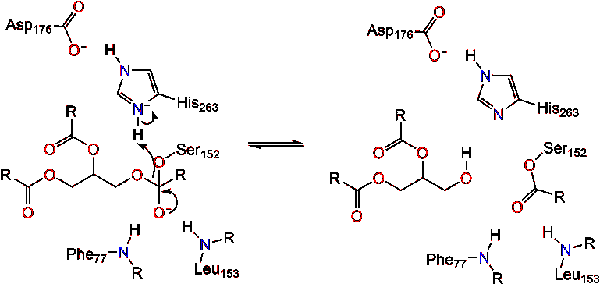
cząsteczka wody przekazuje Proton histydynie, tworząc reaktywny anion hydroksylowy. Anion hydroksylowy może następnie atakować węgiel karbonylowy lipidu, tworząc inny Ujemnie naładowany czworościenny związek pośredni, który jest stabilizowany w otworze oksyanionowym (reakcja 3).,
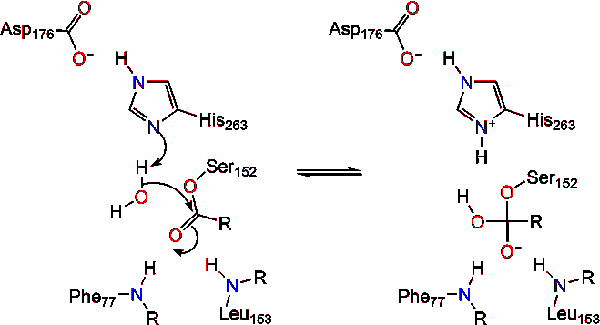
po reformacji karbonylu, seryna katalityczna jest uwalniana, a monogliceryd i monomery kwasów tłuszczowych dyfundują (reakcja 4).
hamowanie lipazy trzustkowej
(fioletowy), fosfonian alkilowy C11, jest kompetycyjnym inhibitorem lipazy trzustkowej. Wiąże się bezpośrednio w kieszeni aktywnego miejsca. Istnieje również pięć cząsteczek B-oktyloglukozydu (szarego i Czerwonego), które kojarzą się z lipazą., MUP tworzy wiązania wodorowe z: Ser 152 i His 263, które są częścią triady katalitycznej, oraz Phe 77 i Leu 153, które są pozostałościami stabilizującymi znajdującymi się w otworze oksyanionowym .MUP został pokazany przez van der Waalsa kontakty z hydrofobowych łańcuchów bocznych Ala 178, Phe 215, Pro l80, Tyr ll4, Leu 213 (pokazane na niebiesko).
interakcje białko – substrat
lipaza wiąże się z licznymi kontaktami hydrofobowymi. Jak widać, lipaza wchodzi w interakcję z grupą alkilową linoleinianu cholesterylu poprzez hydrofobową szczelinę w białku., Ta szczelina orientuje cząsteczkę w celu optymalizacji reakcji lipolizy.
pokazana w tej scenie lipaza z drożdży Candida rugosa w dwóch cząsteczkach linoleinianu cholesterylu (szary). Pozostałości aktywnego miejsca, w tym Ser152, Asp176 i His263, są pokazane w reprezentacji czerwonego kija. Lipaza może pomieścić dwie cząsteczki lipidów ze względu na fakt, że dwie identyczne podjednostki katalizują identyczną reakcję. Jedna cząsteczka lipazy może katalizować dwie reakcje lipolizy na raz.,
znaczenie kliniczne
lipaza trzustkowa jest wydzielana do dwunastnicy przez układ kanałowy trzustki. U zdrowego osobnika jest on w bardzo niskim stężeniu w surowicy. W przypadku ekstremalnych zaburzeń funkcji trzustki, takich jak zapalenie trzustki lub rak trzustki, trzustka może zacząć trawić się i uwalniać enzymy trzustkowe, w tym lipazę trzustkową do surowicy. Pomiar stężenia lipazy trzustkowej w surowicy może zatem pomóc w diagnostyce ostrego zapalenia trzustki.., Ze względu na aktywność lipazy w trawieniu i wchłanianiu tłuszczu, istnieje rosnący rynek inhibitorów lipazy dla farmaceutyków odchudzających. Najbardziej popularny jest Orlistat (lub Xenical®), który jest naturalnym produktem Streptomyces Toxytricini i jest produktem uwodornienia lipostacji-nieodwracalnego inhibitora lipazy. Inhibitor ten działa również poprzez wiązanie Ser152, wytwarzając ester, który hydrolizuje tak wolno, że jest praktycznie nieodwracalny .
konstrukcje 3D lipazy
konstrukcje 3D lipazy