wysoko zorganizowane struktury białek to prawdziwe arcydzieła architektury chemicznej. Ale wysoce zorganizowane struktury mają tendencję do pewnej delikatności, a to dotyczy białek. Denaturacja jest terminem używanym dla każdej zmiany w trójwymiarowej strukturze białka, która sprawia, że nie jest ona w stanie wykonywać przypisanej jej funkcji. Denaturowane białko nie może wykonać swojej pracy. (Czasami denaturacja jest utożsamiana z wytrącaniem lub koagulacją białka; nasza definicja jest nieco szersza.,) Wiele różnych odczynników i warunków, takich jak ciepło, związki organiczne, zmiany pH i jony metali ciężkich, może powodować denaturację białek.
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
stosowanie związków organicznych, takich jak alkohol etylowy |
związki te są zdolne do angażowania się w międzycząsteczkowe wiązanie wodorowe z cząsteczkami białka, zakłócając wewnątrzcząsteczkowe wiązanie wodorowe w białku., |
|
Sole jonów metali ciężkich, takich jak rtęć, srebro i ołów |
jony te tworzą silne wiązania z anionami karboksylowymi kwaśnych aminokwasów lub grup SH cysteiny, zakłócając wiązania jonowe i wiązania dwusiarczkowe. |
|
odczynniki Alkaloidowe, takie jak kwas taninowy (stosowany w garbnikach) |
te odczynniki łączą się z dodatnio naładowanymi grupami aminowymi w białkach, aby zakłócić wiązania jonowe., |
każdy, kto usmażył jajko, zaobserwował denaturację. Przezroczyste białko jaja staje się nieprzezroczyste, gdy albumina denaturuje i koaguluje. Nikt jeszcze nie odwrócił tego procesu. Jednakże, biorąc pod uwagę właściwe okoliczności i wystarczająco dużo czasu, białko, które rozwinęło się w wystarczająco łagodnych warunkach, może się ponownie gromadzić i ponownie wykazywać aktywność biologiczną (rysunek 2.5.1). Takie dowody sugerują, że przynajmniej dla tych białek struktura pierwotna determinuje strukturę drugorzędową i trzeciorzędową., Dana sekwencja aminokwasów wydaje się przyjmować swój szczególny układ trójwymiarowy (3D) naturalnie, jeśli warunki są właściwe.
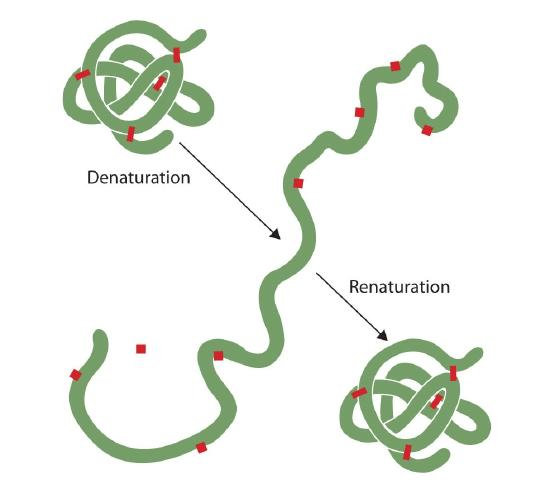
podstawowe struktury białek są dość wytrzymałe., Ogólnie rzecz biorąc, dość energiczne warunki są potrzebne do hydrolizy wiązań peptydowych. Na poziomie wtórnym przez czwartorzędowe, jednak białka są dość podatne na atak, choć różnią się podatnością na denaturację. Delikatnie pofałdowane białka kuliste są znacznie łatwiejsze do denaturowania niż twarde, włókniste białka włosów i skóry.
podsumowanie
białka można podzielić na dwie kategorie: włókniste, które wydają się być nierozpuszczalne w wodzie, i kuliste, które są bardziej rozpuszczalne w wodzie. Białko może mieć do czterech poziomów struktury., Pierwotna struktura składa się z określonej sekwencji aminokwasów. Powstały łańcuch peptydowy może tworzyć α-helisę lub β-plisowany arkusz (lub lokalne struktury nie tak łatwo skategoryzowane), który jest znany jako struktura wtórna. Te segmenty struktury wtórnej są włączone do struktury trzeciorzędowej złożonego łańcucha polipeptydowego. Struktura czwartorzędowa opisuje rozmieszczenie podjednostek w białku zawierającym więcej niż jedną podjednostkę., Cztery główne rodzaje atrakcyjnych oddziaływań determinują kształt i stabilność złożonego białka: wiązanie jonowe, wiązanie wodorowe, wiązania dwusiarczkowe i siły dyspersji. Wiele różnych odczynników i warunków może powodować rozkładanie się białka lub denaturę.