warmte en temperatuur zijn een nauw verwant onderwerp, en als zodanig, het verschil tussen de twee kan een beetje verwarrend. Het kernverschil is dat warmte zich bezighoudt met thermische energie, terwijl temperatuur zich meer bezighoudt met moleculaire kinetische energie.
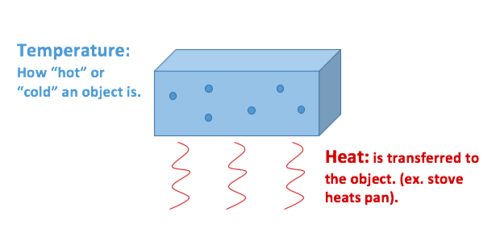
warmte is de overdracht van thermische energie, terwijl temperatuur een eigenschap is die het object vertoont.
Wat is het verschil?,
warmte beschrijft de overdracht van thermische energie tussen moleculen binnen een systeem en wordt gemeten in Joule. Warmte meet hoe energie beweegt of stroomt. Een object kan warmte krijgen of verliezen, maar het kan geen warmte hebben. Warmte is een maat voor verandering, nooit een eigenschap die door een object of systeem wordt bezeten. Daarom wordt het geclassificeerd als een procesvariabele.
temperatuur beschrijft de gemiddelde kinetische energie van moleculen in een materiaal of systeem en wordt gemeten in Celsius (°C), Kelvin(K), Fahrenheit (°F) of Rankine (R)., Het is een meetbare fysische eigenschap van een object—ook bekend als een toestandsvariabele. Andere meetbare fysische eigenschappen zijn snelheid, massa en dichtheid, om er maar een paar te noemen.
overeenkomsten
warmte is een overdracht van thermische energie veroorzaakt door een verschil in temperatuur tussen moleculen.
opmerking:
thermische energie kan anderszins worden begrepen als de totale microscopische kinetische en potentiële energie van een systeem.,
Tweede Wet van de thermodynamica
de tweede wet van de thermodynamica is een complex onderwerp dat intensieve studie op het gebied van de thermodynamica vereist om echt te begrijpen. Voor de toepassing van dit artikel moet echter slechts één klein aspect worden begrepen en dat is het feit dat warmte altijd spontaan van hetere naar koudere stoffen zal stromen. Deze eenvoudige verklaring verklaart waarom een ijsblokje zich niet buiten vormt op een warme dag of waarom het smelt wanneer het in een kom met warm water wordt gegooid.,
gedachte—experiment
stel je voor dat het eerder genoemde ijsblokje in een kom met warm water valt-het ijs moet warmte (thermische energie) krijgen van het water in de kom (zie voorgaande paragraaf). Het toevoegen van thermische energie leidt tot een toename van de kinetische energie van het ijsmolecuul, en dus tot een toename van de temperatuur. Dit is bekend omdat temperatuur in feite de maat is van de gemiddelde kinetische energie van de moleculen. Bovendien zal het ijs thermische energie blijven winnen waardoor de moleculen sneller bewegen en uiteindelijk hun intermoleculaire bindingen breken of smelten.,
samenvattend kan worden gesteld dat de overdracht van warmte of thermische energie gewoonlijk de temperatuur van de stof zal veranderen, maar niet altijd! Bijvoorbeeld, op het moment dat het ijs in de kom verandert in water zullen die watermoleculen precies dezelfde temperatuur hebben als toen ze ijs waren. In dit geval, in plaats van de thermische energie doen werk om de kinetische energie te verhogen, het werkt om de intermoleculaire banden te breken, waardoor een verandering van toestand., Echter, naarmate de tijd vordert zal de temperatuur van het onlangs gesmolten ijs toenemen totdat alles in de kom evenwicht bereikt—wat betekent een consistente temperatuur in de hele.
voor verdere uitlezing
- warmte
- temperatuur
- thermische energie
- kinetische energie
- interne energie
- of onderzoek een willekeurige pagina