Stap 1
in de eerste stap neemt het ethaanzuur een proton (een waterstofion) uit het geconcentreerde zwavelzuur. Het proton wordt vastgemaakt aan een van de eenzame paren op de zuurstof die dubbel gebonden is aan de koolstof.
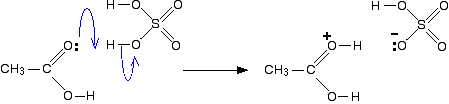
de overdracht van het proton naar de zuurstof geeft het een positieve lading, maar het is eigenlijk misleidend om de structuur op deze manier te tekenen (hoewel bijna iedereen dat doet!).,
de positieve lading wordt over het gehele rechter uiteinde van het ion verplaatst, met een redelijke mate van positiviteit op het koolstofatoom. Met andere woorden, u kunt denken aan een elektronenpaar verschuiving om deze structuur te geven:
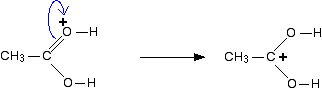
U kunt zich ook een andere elektronenpaar verschuiving produceren een derde structuur:
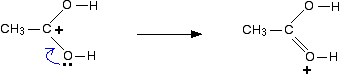
dus welke van deze is de juiste structuur van het gevormde ion? Geen van hen! De waarheid ligt ergens tussen hen in., Een manier om de gedelokaliseerde structuur van het ion te schrijven is als volgt:
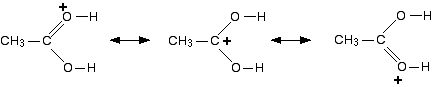
de tweekoppige pijlen vertellen je dat elk van de afzonderlijke structuren een bijdrage levert aan de reële structuur van het ion. Ze betekenen niet dat de bindingen heen en weer draaien tussen de ene structuur en de andere. De verschillende structuren staan bekend als resonantiestructuren of canonieke vormen.
Er zal een zekere mate van positieve lading zijn op zowel de zuurstofatomen als op het koolstofatoom., Elk van de bindingen tussen de koolstof en de twee zuurstofatomen zal hetzelfde zijn – ergens tussen een enkele binding en een dubbele binding.