Inleiding
Lipase katalyseert de afbraak van lipiden door de esters van vetzuren te hydrolyseren. De functie is belangrijk voor de spijsvertering en het bevorderen van de opname van vetten in de darmen. Lipase wordt voornamelijk gevonden in en afgescheiden door de alvleesklier, maar wordt ook gevonden in het speeksel en de maag.
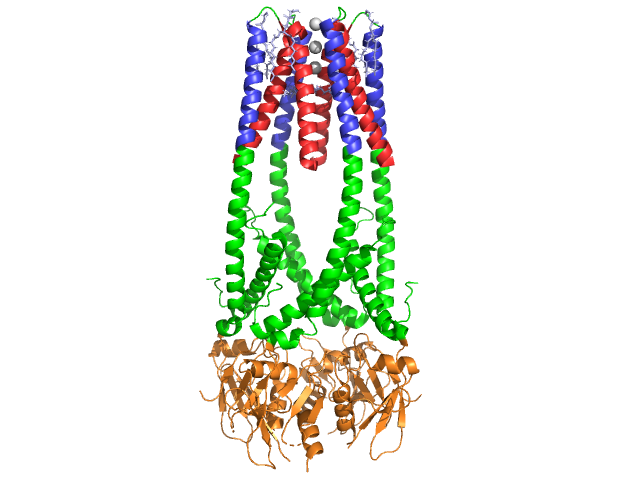
- pancreaslipase (PDB ID: 1hpl) dat rechts afgebeeld is, is een carboxyl-esterhydrolase. Het wordt ook algemeen genoemd pancreatische triacylglycerollipase en zijn enzymklasse aantal is E. C. 3.1.1.3 .,
- het galzout gestimuleerde lipase (BSSL) wordt aangetroffen in moedermelk.
- de hormoongevoelige lipase (LIPE) hydrolyseert een verscheidenheid aan esters. Voor details zie Hormone sensitive lipase.
- Monoacylglycerollipase (MAGL) hydrolyseert intracellulaire triglyceriden tot vetzuren en glycerol. MAGL werkt samen met LIPE. Voor details zie Monoglyceride lipase.
de door het enzym gekatalyseerde reactie wordt hieronder weergegeven.
verdere afbraak resulteert uiteindelijk in 2-monoacylglycerolen en vrije vetzuren ., Een diepgaande bespreking van het mechanisme kan worden gevonden in de lipase katalytische mechanisme sectie. De bepaling van de structuur en functie van lipase was een geleidelijk proces. Lipase activiteit werd voor het eerst aangetoond in de alvleesklier door Claude Bernard in 1846. Nochtans, was het niet tot 1955 dat Mattson en Beck een hoge specificiteit van alvleesklierlipase voor triglyceride primaire esters demonstreerden . In de afgelopen jaren, is de bepaling van de kristalstructuur van alvleesklierlipase de primaire nadruk geworden aangezien vele wetenschappers hebben gewerkt om dit te bevorderen.,
Zie ook:
- Moleculaire Speeltuin/Pancreas Lipase
- Lipase deksel morph
- hormoongevoelige lipase
- Lipase van Candida antarctica in gesloten toestand
- Monoglyceride lipase
- de Menselijke maag-lipase
- Lipase (hebreeuws)
- Lipide metabolisme
Structuur
de Pancreas lipase is een 50 kDa eiwit., Terwijl de kristallografische asymmetrische eenheid twee identieke ketens bevat, geeft informatie (opmerking 350) in het gegevensbestand 1hpl aan dat het dimeer een kristallisatie-artefact is, en dat de functionele vorm (ook wel de biologische assemblage genoemd) een enkele keten (monomeer) is. De keten bestaat uit 449 residuen . De s van lipase (in één subeenheid) omvatten 102 residuen die 13 alpha helices creëren, getoond in rood, en 139 residuen betrokken bij beta platen in totaal 28 strengen, getoond in goud. De Alfa-helices zijn goed voor 22% van het eiwit, terwijl de beta-platen 30% uitmaken., Elke keten bevat twee duidelijk gedefinieerde . Het n terminaal domein, weergegeven in blauw, wordt gekenmerkt door een alfa/beta hydrolase vouw. Terwijl de C terminal domein, weergegeven in groen, bevat een beta sheet sandwich die interageert met colipase . Elke monomeer-en dimeerstructuur van lipase wordt bij elkaar gehouden door disulfidebanden, waterstofbanden en elektrostatische interacties (zoutbruggen). Lipase heeft 12 totaal tussen cysteïne residuen. worden gevormd tussen de positieve lading nitrogenen (blauw) in Arg en Lys, en negatieve zuurstofatomen (rood) in Asp en Glu residuen., (in geel) stabiliseer ook het enzym tussen hoofdketting en zijketting atomen. Lipase heeft een duidelijke verdeling van residuen (paarse ruimte is polaire residuen). Hydrophobic collapse draagt bij aan veel van de secundaire en tertiaire structuren, zoals de (getoond in Wit) deel uitmaken van het interieur van het eiwit, terwijl polaire residuen (transparant blauw) zijn op het oppervlak . Daarnaast heeft lipase er twee . Een is begraven in elke monomeer subeenheid. Het calciumion is essentieel voor eiwitvouwen en enzymactiviteit ., De afbeelding toont het groene calciumion in subeenheid A, gecoördineerd door glu187, Arg190, Asp192 en Asp195 residuen. De ca (+2) lading wordt gestabiliseerd door negatief geladen glutamaat en aspartaatresiduen, en de zuurstofatomen van twee watermoleculen (roze).
bovendien heeft lipase een uniek (groen) middel dat het binnendringen van oplosmiddel in de actieve plaats blokkeert (rood). Het deksel is een 25-residu spiraalvormige structuur die het oxyanion gat beschermt., Het deksel (geel) is vooral belangrijk voor substraatbinding omdat het een dramatische verschuiving ondergaat die de secundaire structuur van de lipase bindingsplaats verandert van een (actieve plaats in rood) naar een (actieve plaats in blauw, triacylglyceride in ruimtevulling) (zie lipase deksel morph voor een animatie van deze overgang). De deksel opening gaat gepaard met een verandering in secundaire structuur van een meestal beta-extended bevestiging naar een structuur waar meer dan de helft van de actieve site wordt gevormd uit alfa helices .,
Colipase co-enzym
Lipase wordt geactiveerd door colipase, een co-enzym dat zich bindt aan het C-terminale, niet-katalytische domein van lipase. Colipase is een 10kda-eiwit dat door de alvleesklier in een inactieve vorm wordt afgescheiden. Het heeft vijf behouden (getoond in geel) , en 2 – een hydrofiele oppervlakte (plaats van lipase C-eindinteractie – getoond in blauw) en een hydrophobic oppervlakte (bevat veelvoudige hydrophobic lussen om lipide – getoond in wit te overbruggen). Trypsine activeert dan colipase voordat de cofactor kan interageren met lipase.,
Colipase moet aanwezig zijn voor de activering van lipase en werkt als een brug tussen lipase en het lipide. Wanneer colipase bindt, wordt de actieve lipase gestabiliseerd voor de hydrophobic interactie met triacylglycerides . Zonder colipase aanwezig, zou de accumulatie van amfifielen bij de olie/water interface in de twaalfvingerige darm pancreaslipase verhinderen om aan zijn substraat te binden. . Colipase en lipase zijn tegenovergesteld aan de actieve plaats op de C-terminal (contacten zijn gebieden van roze en geel, met watermoleculen getoond in donkerder blauw). De enzymen zijn gebonden door polaire interacties zoals, en .,
in aanwezigheid van colipase wordt het enzym geactiveerd dat de (rode, actieve plaats in groen) die bestaat uit aminozuren 216-239 beweegt. De N-terminal flap beweegt op een gecoördineerde manier samen met het C-terminal domein om de actieve plaats (groen) te onthullen, toestaand het om met een substraat te binden. Er wordt verondersteld dat deze flexibiliteit betekenis kan hebben in het binden van het colipase-lipase complex met de water-lipide interface. De reorganisatie van de flap veroorzaakt ook een tweede conformationele verandering die het oxyanion gat creëert.,
lipase-katalytisch mechanisme
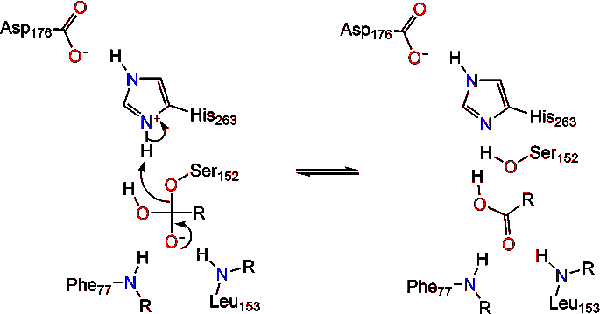
Lipase-activering op het raakvlak tussen lipiden en water van triacylglyceriden, in aanwezigheid van colipase-en galzouten, staat bekend als interfaciale activering. Om de hydroloysis-reactie te laten plaatsvinden, verankert colipase lipase aan het lipide-watermembraan van de micel die een oppervlakteverandering op lipase veroorzaakt. De vier hydrophobic lussen van Colipase interageren met de hydrophobic atmosfeer van triacylglyceride. Dit initieert actieve plaats die aan het lipide binden, en deksel openen om een meer hydrophobic milieu voor triacylglycerol te openbaren., Dit staat op zijn beurt triacylglycerol toe om met zeer belangrijke actieve plaatsresidu ‘ s zoals katalytische triade in wisselwerking te staan. Een divers scala van lipase enzymen kan worden gevonden in de natuur. Hoewel de verschillende vormen diverse eiwitsteigers bezetten, worden de meesten gebouwd op een alpha/beta hydrolase vouw en bezitten chymotrypsine-als samengesteld uit een zuur residu, een histidine, en een serine nucleofiel. In het geval van paard pancreas lipase, de katalytische triade bestaat uit . Deze katalytische triade functioneert zoals de meeste gevonden in de natuur., Ten eerste vormt asparaginezuur een waterstofbinding met zijn 263, waardoor de pKa van de histidine imidazoolstikstof toeneemt. Dit staat histidine toe om als krachtige algemene basis op te treden en serine te deprotoneren. De gedeprotoneerde serine kan dan als nucleofiel dienen en de estercarbonyl van een van de vetzuren aanvallen op de 1 of 3 koolstoffen van de glycerolrugbeenderen van het lipidensubstraat. Bij het aanvallen van het lipide wordt een negatief geladen tetraëdrisch tussenproduct gevormd (reactie 1). Het wordt gestabiliseerd in het oxyanion gat door twee residuen: .,
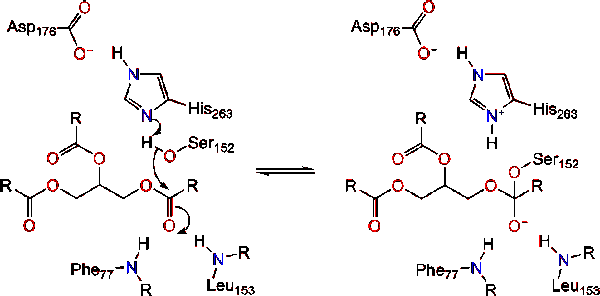
De carbonylhervormingen waarbij het glycerol backbone-segment fungeert als de vertrekgroep (reactie 2).
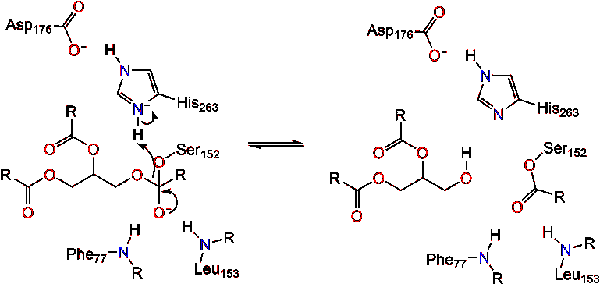
een watermolecuul doneert vervolgens een proton aan het histidine, waardoor een reactief hydroxylanion ontstaat. Het hydroxylanion kan dan de carbonylkoolstof van het lipide aanvallen en een ander negatief geladen tetraëdrisch tussenproduct vormen dat in het oxyaniongat wordt gestabiliseerd (reactie 3).,
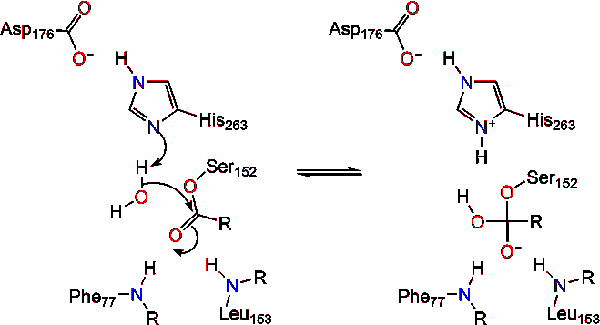
na reformatie van het carbonyl komt de katalytische serine vrij en diffunderen monoglyceride-en vetzuurmonomeren weg (reactie 4).
remming van pancreaslipase
(Paars), een C11-alkylfosfonaat, is een competitieve remmer van pancreaslipase. Het bindt direct in de actieve site pocket. Er zijn ook vijf B-octylglucoside (grijze en rode) molecules die met lipase associëren., MUP vormt waterstofbindingen met: Ser 152 en zijn 263, die deel uitmaken van de katalytische Triade, en Phe 77 en Leu 153, die de stabiliserende residuen zijn die zich in het oxyaniongat bevinden .MUP werd aangetoond door Van der Waals contacten met hydrofobe zijkettingen Ala 178, Phe 215, Pro l80, Tyr ll4, Leu 213 (weergegeven in blauw).
eiwit – substraat interacties
Lipase bindt met talrijke hydrofobe contacten. Zoals hier wordt gezien, interageert de lipase met de alkylgroep van cholesteryllinoleaat via een hydrophobic kloof binnen de proteã ne., Deze scheur oriënteert de molecule om de lipolysereactie te optimaliseren.
in deze scène is lipase van de gist Candida rugosa in met twee moleculen cholesteryllinoleaat (grijs). De actieve plaatsresiduen met inbegrip van Ser152, Asp176, en His263 worden getoond in rode stok vertegenwoordiging. Lipase kan twee lipidemolecules aanpassen toe te schrijven aan het feit dat het twee identieke subeenheden een identieke reactie katalyseert. Eén lipase molecule kan twee lipolysereacties tegelijk katalyseren.,
klinische significantie
pancreaslipase wordt uitgescheiden in de twaalfvingerige darm via het kanaal van de alvleesklier. Bij een gezond individu, is het in zeer lage concentratie in serum. Onder extreme verstoring van pancreasfunctie, zoals pancreatitis of alvleesklierkanker, kan de alvleesklier zichzelf beginnen te verteren en pancreasenzymen met inbegrip van pancreaslipase in serum vrijgeven. Meting van de serumconcentratie van pancreaslipase kan daarom helpen bij de diagnose van acute pancreatitis.., Vanwege de activiteit van lipase in de spijsvertering en absorptie van vet, is er een groeiende markt voor lipase-remmers voor geneesmiddelen voor gewichtsverlies geweest. De meest populaire is Orlistat (of Xenical®) dat is een natuurlijk product van Streptomyces toxytricini en is de hydrogenatie product van lipostatie – een onomkeerbare lipase remmer. Deze inhibitor werkt ook door Ser152 te binden, een ester te produceren die zo langzaam hydrolyseert dat het praktisch onomkeerbaar is .
3D-structuren van Lipase
Lipase 3D-structuren