Lewis structuur van watermolecuul bevat twee enkele bindingen rond zuurstofatoom. aantal totale valentie-elektronen van zuurstof-en waterstofatomen worden gebruikt om de lewis-structuur te tekenen. Elke stap van het tekenen van lewis structuur van H2O worden uitgelegd in deze tutorial.
H2o lewis-structuur
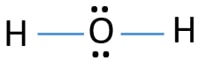
in de lewis-structuur van H2O zijn er twee afzonderlijke bindingen rond zuurstofatoom. Waterstofatomen zijn verbonden met zuurstofatoom door middel van enkele bindingen. Ook zijn er twee eenzame paren op zuurstofatoom.,
watermolecuul is een eenvoudig molecuul. Tekening lewis structuur van watermolecuul is eenvoudig dan sommige andere complexe moleculen of ionen. Stel je tekening lewis structuur van thiosulfaat ion.
stappen voor het tekenen van de lewis-structuur van H2O
Er zijn enkele stappen te volgen om een lewis-structuur correct te tekenen. Voor H2o molecuul, zijn lewis structuur en die stappen worden uitgelegd in detail in deze tutorial. Omdat watermolecule eenvoudig is, worden sommige van deze stappen niet veel gebruikt. In dergelijke gevallen worden ze vermeld met de respectieve stappen.,
- zoek het totale aantal elektronen van de valantieschillen van waterstofatomen en zuurstofatomen
- totale elektronenparen als eenzame paren en bindingen
- Middenatoomselectie
- markeer eenzame paren op atomen
- Markeer ladingen op atomen als die er zijn.
- controleer de stabiliteit en minimaliseer ladingen op atomen door eenzame paren om te zetten in bindingen om de beste lewis-structuur te verkrijgen.
belangrijk: correcte lewis-structuur tekenen is belangrijk om resonantiestructuren correct te tekenen.,
totaal aantal elektronen van de valantieschillen van H2O
Er zijn twee elementen: waterstof en zuurstof. Waterstof is een element van groep IA en heeft slechts één elektron in zijn laatste schil (valentieschelp). Zuurstof is een groep VIA element in het periodiek systeem en bevat zes elektronen in zijn laatste schil. Nu weten we hoeveel elektronen er in valentieschillen van elk atoom zitten.,
- valence elektronen gegeven door waterstof atomen = 1 * 2 = 2
- valence elektronen gegeven door zuurstof atomen = 6*1 = 6
- Totaal valence elektronen = 2 + 6 = 8
Totaal valence elektronen paren
Totaal volant elektronen paren = σ obligaties + π obligaties + eenzame paren in valence-shells
Totaal elektron paren worden bepaald door de verdeling van het totaal aantal valentie elektronen per twee. Voor, H2O, totaal paar elektronen zijn 4 in hun valentie schelpen.,
centrum-atoom van H2O
om het centrum-atoom te zijn, is het vermogen om een grotere valantie te hebben belangrijk. Dan, uit waterstof en zuurstof, welk atoom heeft de hoogste valentie? Maximale valentie van zuurstof is twee. de enige valentie van waterstof is er één. Daarom zou zuurstofatoom het centrum-atoom van H2O moeten zijn. nu kunnen we een schets van H2O tekenen om te laten zien hoe atomen zich in het molecuul bevinden.
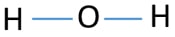
eenzame paren op atomen
na het bepalen van het middenatoom en de schets van het H2o-molecuul, moeten we beginnen met het markeren van eenzame paren op atomen., Onthoud dat er in totaal vier elektronenparen zijn.
- er zijn al twee H-O-bindingen in de getekende schetsstructuur. Nu zijn er nog maar twee (4-2) elektronenparen over om op atomen te markeren.
- gewoonlijk moeten die resterende elektronenparen worden gestart om externe atomen te markeren. Maar in H2O zijn waterstofatomen de buitenste atomen die niet meer dan twee elektronen in hun laatste schil kunnen houden. Daarom kunnen we die twee elektronenparen niet markeren op waterstofatomen.,
- markeer dan deze twee elektronenparen op het middenatoom; zuurstof

Markladingen op atomen
Er zijn geen ladingen op zuurstofatomen en waterstofatomen.
controleer de stabiliteit en minimaliseer ladingen op atomen door eenzame paren om te zetten in bindingen
omdat er geen ladingen op atomen zijn, is het niet nodig om ladingen te verminderen als een stap om de beste lewis-structuur te tekenen. We hebben al de beste lewis-structuur voor H2o.
vragen
waarvoor kunnen de lewis-structuren met water worden getrokken?,
in de lewis-structuur van het watermolecuul zijn er twee sigma-bindingen en twee eenzame paren rond zwavelatomen. Waterstofsulfide, zuurstofdifluoride (F2O) hebben vergelijkbare structuren als water.
Stel uw scheikundevragen en vind de antwoorden
gerelateerde Tutorials