Wat is een Ion?
een ion is een atoom of molecuul dat een elektrische lading draagt.
ionen worden geïdentificeerd door het gebruik van een superscript om het teken en de grootte van hun elektrische lading aan te geven.
anionen en kationen
negatief geladen ionen worden anionen genoemd, en positief geladen ionen worden kationen genoemd.,n atoom krijgt er drie elektronen worden N3-
Voorbeelden van Kationen
- een natrium-atoom een elektron kwijtraakt te worden Na
- een magnesium-atoom verliest twee elektronen worden Mg2+
- een ijzer-atoom verliest drie elektronen worden Fe3+
- water reageert met H+ om de vorm van de moleculaire kation H3O+
Ion Vorming
– Ionen vormen bij het doen van zo minimaliseert de totale potentiële energie van de chemische soorten die betrokken zijn bij de chemische reactie.,Vaak wordt dit bereikt door atomen van verschillende elementen toe te staan om een volledige schil van elektronen te bereiken.
beschouw het zout lithiumfluoride:
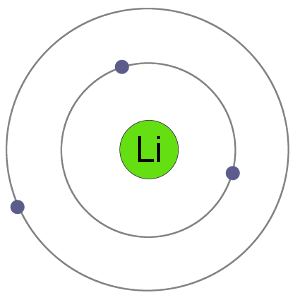
Lithiumatomen hebben 3 elektronen, wat betekent dat ze elektronen in twee schalen hebben: 2 in de eerste schil en 1 in de second.By het verliezen van een elektron om een kation te worden, krijgt lithium een stabiele elektronenregeling, identiek aan die van het edelgas helium.,
Li Atom
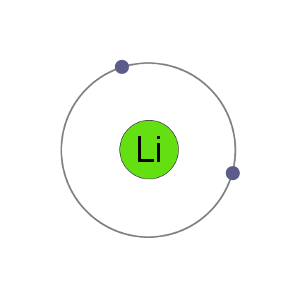
Li+ Kation
Fluor atomen heeft 9 elektronen, wat betekent dat ze nog 2 in de eerste shell en 7 in de second.By het verkrijgen van een elektron om een anion de fluoride-ion krijgt een stabiele elektronen-regeling, identiek aan die van het edelgas neon.,”e9c2d99c83″>
En zo de redox-reactie van natrium met chloor in de vorm van een ionische verbinding is energetisch gunstig:
Vermindering van chloor: Cl2 + 2e- → 2Cl-
Algemene reactie: 2Na + Cl2 → 2NaCl
Ion Maten
Kationen zijn kleiner dan de originele atom – bedenk hoe het natrium atoom elektronen in drie schelpen, terwijl de natrium-ion elektronen in slechts twee schelpen.,Met meer elektronen zijn anionen groter dan het oorspronkelijke atoom.
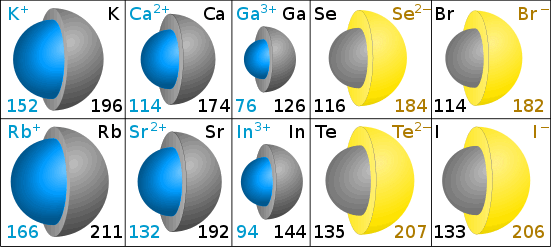
Iongroottes worden gemeten aan de hand van de ionstraal.
Ionstralen in Picometers
De grijze kleur in de diagrammen toont de grootte van het oorspronkelijke atoom. Het blauw (kation) en geel (anion) geven de grootte van het ion aan. (Diagrammen van Chris King.)

Ionverbindingen
Ionverbindingen, zoals natriumchloride (NaCl), worden gevormd door de elektrostatische aantrekking tussen anionen en kationen.,Ionverbindingen zijn elektrisch neutraal, omdat het totale aantal positieve ladingen en het totale aantal negatieve ladingen altijd gelijk zijn.
rekening houdend met de chemische elementen, bestaat de grootste neiging tot het vormen van ionverbindingen in de minst elektronegatieve metalen en de meest elektronegatieve niet-metalen.
elektrische geleiders
ionen kunnen elektrische stroom dragen; dit kan bijvoorbeeld worden waargenomen in elektrochemische cellen en in plasma.
in het algemeen dragen vaste ionverbindingen geen elektrische stroom, omdat de ionen vastzitten in een kristalrooster.,Ionverbindingen geleiden alleen elektriciteit wanneer ze gesmolten zijn of opgelost in een oplossing, wanneer de ionen vrijkomen uit het kristalrooster en mobiel worden.