kaliumsulfide vertegenwoordigd door de chemische formule K2S is een verbinding van kalium en zwavel die matig oplosbaar is in zuren . Het is deliquescent en kan spontaan ontbranden in de lucht. Het is een reductiemiddel en een ionische verbinding .

kaliumsulfide
Samenstelling en synthese
kaliumsulfide kan worden bereid door eerst kaliumhydroxide te behandelen tot een teveel aan waterstofsulfide om kaliumhydrosulfide (KHS) te vormen., Verdere behandeling van KHS met dezelfde hoeveelheid kaliumhydroxide genereert kaliumsulfide .,H2S = KHS + H2O
KHS + KOH = K2S + H2O

Potassium Sulfide Formula
Properties and Characteristics of Potassium Sulfide
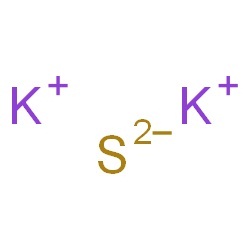
Potassium Sulfide Structure
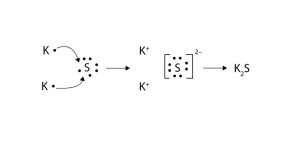
Lewis Dot Structure for Potassium Sulfide
Prominent Reactions of K2S
Potassium sulfide reacts with cobalt iii bromide to produce cobalt iii sulfide and potassium bromide .,
3K2S + 2CoBr3 = Co2S3 + 6KBr
kaliumsulfide reageert met verdund zoutzuur om kaliumchloride en waterstofsulfide te produceren .
K2S + 2HCl = 2 KCl + H2S
het reageert met geconcentreerd zwavelzuur tot kaliumbisulfaat, zwaveldioxide, zwavel en water
K2S + 3H2SO4 = 2KHSO4 + SO2 + S + 2H20
de verbinding reageert met zilvernitraat tot waterig kaliumnitraat en zilversulfideprecipitaat .
K2S + 2AgNO3 = 2KNO3 + Ag2S
gebruik van kaliumsulfide
- In Pyrotechniek .
- als reagens in de Analytische Chemie .,
- als ontharingsmiddel en geneesmiddel .
is het gevaarlijk
kan het brandgevaar veroorzaken, daarom moeten voorzorgsmaatregelen worden genomen om het niet in contact te brengen met lucht. In de vorm van poeder of stof is het explosief. Inslikken, inademing en huidcontact kunnen leiden tot ernstig letsel en zelfs de dood. Het beïnvloedt ook schadelijk de ogen en de huid waardoor oogschade en huidbrandwonden. Daarom moet elk contact vermeden worden. Het stoot giftige dampen uit als het wordt verhit tot ontbinding . Het is van corrosieve aard en giftig voor het milieu .
- kaliumsulfide-Americaanelementen.,com
- kaliumsulfide – Chemspider.com
- kaliumsulfide – Pubchem.ncbi.nlm.nih.gov
- kaliumsulfide – Chemicalbook.com
- It K2S zuur of basisch? – Quora.com
- Dikaliumsulfide – Webelements.com
- Wat zijn de toepassingen van kaliumsulfida? – Quora.com
- kaliumsulfide – Merckmillipore.com
- preparaat van kaliumsulfide – Prepchem.com
- Oplosbaarheidsregels en Net Ionische vergelijkingen praktijk – Vincentianacademy.org
- Kaliumsulfida reageren met waterstofchloride-Chemiday.,com
- Question #e42f1 – Socratic.org
- Potassium sulfide react with sulfuric acid – Chemiday.com