de sterk georganiseerde structuren van eiwitten zijn werkelijk meesterwerken van de chemische architectuur. Maar hoog georganiseerde structuren hebben de neiging om een bepaalde delicatesse te hebben, en dit geldt voor eiwitten. Denaturatie is de term die voor om het even welke verandering in de driedimensionale structuur van een proteã ne wordt gebruikt die het onbekwaam maakt om zijn toegewezen functie uit te voeren. Een gedenatureerd eiwit kan zijn werk niet doen. (Denaturatie wordt soms gelijkgesteld met precipitatie of coagulatie van een eiwit; onze definitie is iets breder.,) Een grote verscheidenheid van reagentia en voorwaarden, zoals hitte, organische samenstellingen, pH veranderingen, en zware metaalionen kunnen eiwitdenaturatie veroorzaken.
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
gebruik van organische verbindingen, zoals ethylalcohol |
deze verbindingen kunnen intermoleculaire waterstofbinding met eiwitmoleculen aangaan, waardoor de intramoleculaire waterstofbinding binnen het eiwit wordt verstoord., |
|
zouten van zware metaalionen, zoals kwik, zilver en lood |
deze ionen vormen sterke bindingen met de carboxylaatanionen van de zure aminozuren of SH-groepen van cysteïne, waardoor ionenbindingen en disulfidebindingen worden verstoord. |
|
alkaloïde reagentia, zoals looizuur (gebruikt in looizuur) |
deze reagentia combineren met positief geladen aminogroepen in eiwitten om ionenbindingen te verstoren., |
Iedereen die een ei heeft gebakken, heeft denaturatie waargenomen. Het heldere eiwit wordt ondoorzichtig als de albumine denatureert en stolt. Niemand heeft dat proces nog ongedaan gemaakt. Echter, gezien de juiste omstandigheden en voldoende tijd, kan een eiwit dat zich onder voldoende zachte omstandigheden heeft ontvouwen opnieuw vouwen en kan opnieuw biologische activiteit vertonen (figuur 2.5.1). Dergelijk bewijsmateriaal stelt voor dat, minstens voor deze proteã nen, de primaire structuur de secundaire en tertiaire structuur bepaalt., Een bepaalde opeenvolging van aminozuren schijnt zijn bijzondere driedimensionale (3D) regeling natuurlijk aan te nemen als de voorwaarden juist zijn.
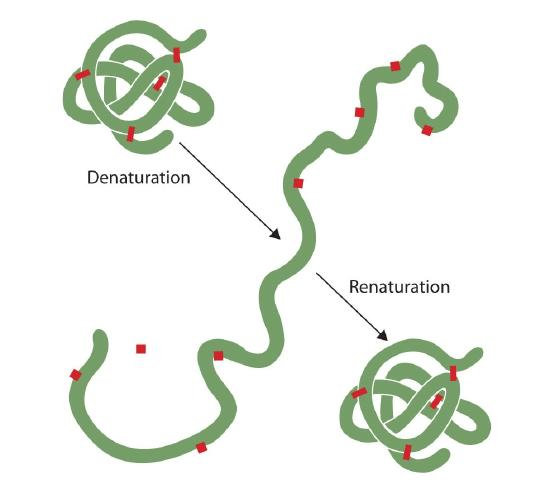
de primaire structuren van eiwitten zijn vrij stevig., In het algemeen, zijn vrij krachtige voorwaarden nodig om peptide banden te hydrolyseren. Op de secundaire door quaternaire niveaus, nochtans, zijn de proteã nen vrij kwetsbaar voor aanval, hoewel zij in hun kwetsbaarheid voor denaturatie variëren. De fijn gevouwen bolvormige eiwitten zijn veel gemakkelijker te denatureren dan de taaie, vezelige eiwitten van haar en huid.
samenvatting
eiwitten kunnen in twee categorieën worden onderverdeeld: vezelig, dat doorgaans onoplosbaar is in water, en bolvormig, dat beter oplosbaar is in water. Een eiwit kan tot vier niveaus van structuur hebben., De primaire structuur bestaat uit de specifieke aminozuuropeenvolging. De resulterende peptide ketting kan een α-helix of β-geplooid blad (of lokale structuren niet zo gemakkelijk gecategoriseerd) vormen, dat als secundaire structuur bekend is. Deze segmenten van secundaire structuur worden opgenomen in de tertiaire structuur van de gevouwen polypeptideketen. De quaternaire structuur beschrijft de regelingen van subeenheden in een proteã ne die meer dan één subeenheid bevat., Vier belangrijke soorten aantrekkelijke interacties bepalen de vorm en stabiliteit van het gevouwen eiwit: ionische binding, waterstofbinding, disulfideverbindingen en dispersiekrachten. Een grote verscheidenheid van reagentia en voorwaarden kan leiden tot een eiwit te ontvouwen of denatureren.