Varme og temperatur er et nært beslektet tema, og som sådan, er forskjellen mellom de to kan være litt forvirrende. Kjernen forskjellen er at varme avtaler med termisk energi, mens temperaturen er mer opptatt av molekylære kinetisk energi.
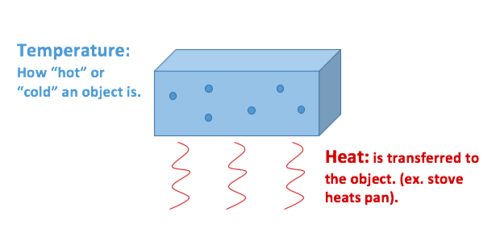
Varme, som er overføring av termisk energi, mens temperaturen er en eiendom objektet utstillinger.
Hva er forskjellen?,
Varme beskriver overføring av termisk energi mellom molekyler i et system, og er målt i Joule. Varme tiltak for hvordan energi beveger seg, eller flyter. Et objekt kan få varme eller miste varmen, men det kan ikke ha varme. Varme er et mål på endring, aldri en eiendom som er besatt av et objekt eller et system. Det er derfor klassifisert som en prosess variabel.
Temperatur beskriver den gjennomsnittlige kinetiske energien til molekylene i en material-eller system, og er målt i Celsius (°C), Kelvin(K), Fahrenheit (°F), eller Rankine (R)., Det er en målbar fysisk egenskap ved et objekt—også kjent som en tilstand variabel. Andre målbare fysiske egenskaper inkluderer hastighet, masse og tetthet, for å nevne noen.
Likheter
Varme, som er overføring av termisk energi forårsaket av en forskjell i temperatur mellom molekyler.
Merk:
Termisk energi kan være noe annet forstås som den totale mikroskopiske kinetisk og potensiell energi i et system.,
Andre Lov Termodynamikk
termodynamikkens andre lov er et komplekst tema som krever intensiv studie innen termodynamikk for å virkelig forstå. Imidlertid, for hensikten med denne artikkelen, er bare en liten aspekt behov for å bli forstått, og det er det faktum at varmen vil alltid flyte spontant fra varmere stoffer til kaldere seg. Dette enkle utsagnet forklarer hvorfor en isbit ikke form ute på en varm dag eller hvorfor det smelter når det blir sluppet i en bolle med varmt vann.,
Trodde eksperiment
Tenk deg de nevnte ice cube falt inn i en skål med varmt vann—isen må få varme (termisk energi) fra vannet i bollen (se foregående avsnitt). Legge til termisk energi fører til en økning i den kinetiske energien av is-molekylet, og dermed en økning i temperatur. Dette er kjent fordi temperaturen er faktisk mål på den gjennomsnittlige kinetiske energien til molekylene. Videre, isen vil fortsette å få termisk energi forårsaker sin molekyler til å bevege seg raskere og til slutt bryte sine intermolecular obligasjoner eller smelte.,
I konklusjonen, overføring av varme eller termisk energi vil vanligvis endre temperaturen til stoffet, men ikke alltid! For eksempel, i det øyeblikket når isen i bollen blir til vann de vannmolekylene vil være på nøyaktig samme temperatur som da de var is. I dette tilfellet, i stedet for termisk energi ved å gjøre jobber for å øke den kinetiske energien, det fungerer å bryte intermolecular obligasjoner, forårsaker en endring av tilstand., Imidlertid, etter hvert som tiden går temperaturen på den nylig smeltet isen vil øke til alt i bollen når likevekt—noe som betyr en jevn temperatur hele tiden.
For Videre Lesing
- Varme
- Temperatur
- Termisk energi
- Kinetisk energi
- en Indre energi
- Eller utforske en tilfeldig side