Innledning
Lipase catalyzes nedbryting av lipider ved hydrolyzing den estere av fettsyrer. Dens funksjon er viktig for fordøyelsen og fremme opptaket av fett i tarmen. Lipase er først og fremst funnet i og skilles ut fra bukspyttkjertelen, men er også funnet i spytt og mage.
- Bukspyttkjertelen lipase (PDB-ID: 1hpl) som er avbildet til høyre, er en karboksylsyre ester hydrolase. Det er også ofte kalles bukspyttkjertelen triacylglycerol lipase og dens enzym klasse antall er E. C. 3.1.1.3 .,
- galle salt-stimulert lipase (BSSL) er funnet i morsmelk.
- hormon-sensitiv lipase (LIPE) hydrolyzes et utvalg av estere. For mer informasjon, se Hormon sensitiv lipase.
- Monoacylglycerol lipase (MAGL) hydrolyzes intracellulære triglyserider til fettsyrer og glyserol. MAGL funksjoner sammen med LIPE. For mer informasjon, se Monoglyceride lipase.
reaksjonen catalyzed av enzymet er vist nedenfor.
Ytterligere nedbryting til slutt resulterer i 2-monoacylglycerols og frie fettsyrer ., En grundig diskusjon av mekanismen kan bli funnet i Lipase Katalytisk Mekanisme delen. Bestemmelse av struktur og funksjon av lipase var en gradvis prosess. Lipase aktivitet ble første gang påvist i bukspyttkjertelen av Claude Bernard i 1846. Men det var ikke før i 1955 at Mattson og Beck vist en høy spesifisitet av bukspyttkjertelen lipase for triglyserid primære estere . I de siste årene, fastsettelse av krystallstruktur av bukspyttkjertelen lipase har blitt det primære fokus som mange forskere har arbeidet for å fremme dette.,
Se også:
- Molekylær Lekeplass/Bukspyttkjertelen Lipase
- Lipase lokket morph
- Hormon sensitiv lipase
- Lipase fra Candida antarktis i lukket tilstand
- Monoglyceride lipase
- Menneskets mage-lipase
- Lipase (hebraisk)
- Lipid metabolisme
– Struktur
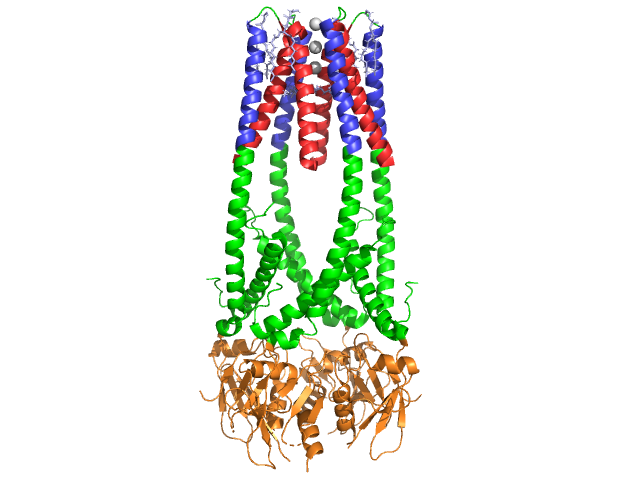
Bukspyttkjertelen lipase er en 50 kDa protein., Mens krystallografisk asymmetrisk enheten inneholder to identiske lenker, informasjon (BEMERKNING 350) i datafilen 1hpl indikerer at dimer er en krystallisering artefakt, og at funksjonsformen (også kalt biologisk montering) er et enkelt kjede (monomer). Kjeden består av 449 rester . S av lipase (i en subunit) inkluderer 102 rester som skaper 13 alpha helices, vises i rødt, og 139 rester involvert i beta ark totalt 28 tråder, vist i gull. Alfa helices konto for 22% av protein, mens beta-ark består av 30%., Hver linje inneholder to godt definert . N-terminal domene, vist i blått, er preget av en alpha/beta hydrolase brett. Mens C-terminal domene, som vises i grønt, inneholder en beta ark sandwich som samhandler med colipase . Hver monomer og dimer struktur av lipase er holdt sammen av disulfide obligasjoner, hydrogen obligasjoner, og elektrostatiske interaksjoner (salt broer). Lipase har 12 totalt mellom cystein rester. er dannet mellom positivt lade nitrogens (blå) i Arg og Lys, og negative oxygens (rød) i Asp og Glu rester., (i gult) også stabilisere enzym mellom største kjeden og siden kjeden atomer. Lipase har en tydelig fordeling av reststoffer (lilla spacefill representerer polar rester). Hydrofobe kollaps bidrar til mye av den sekundære og tertiære strukturer, som (vises i hvitt) utgjør det indre av protein, mens polar rester (gjennomsiktig blå) er på overflaten . I tillegg, lipase har to . En som er gravlagt i hver monomer subunit. Kalsium ion er viktig å protein folding og enzymaktivitet ., Bildet viser den grønne kalsium ion i subunit En koordinert av Glu187, Arg190, Asp192, og Asp195 rester. Ca(+2) kostnad er stabilisert ved negativt ladet glutamat og aspartat rester, og oksygen atomer fra to vannmolekyler (rosa).
I tillegg, lipase har en unik (grønn) som blokkerer løsemiddel fra å komme inn i det aktive området (rødt). Lokket er en 25-rester spiralformet struktur som beskytter oxyanion hull., Lokket (gul) er spesielt viktig å substrat bindende som det gjennomgår en dramatisk endring som endrer sekundær struktur av lipase bindende nettstedet fra en (aktive området i rødt) til en (aktive området i blått, triacylglyceride i spacefill) (se Lipase lokket forvandle seg til en animasjon av denne overgangen). Lokket åpning er ledsaget av en endring i sekundær struktur fra en hovedsakelig beta-utvidet bekreftelse til en struktur der mer enn halvparten av det aktive nettstedet er dannet fra alpha helices .,
Colipase Koenzym
Lipase er aktivert av colipase, et koenzym som binder seg til C-terminal, ikke-katalytisk domene av lipase. Colipase er en 10kDa proteiner som skilles ut fra bukspyttkjertelen i en inaktiv form. Det har fem bevart (vist i gult) , og 2 – en hydrofil overflaten (område av lipase-C-terminal interaction – vist i blått) og hydrofobe overflaten (inneholder flere hydrofobe løkker til å bygge bro lipid – vises i hvitt). Trypsin vil da aktivere colipase før kofaktor kan samhandle med lipase.,
Colipase må være til stede for aktivering av lipase, og fungerer som en bro mellom lipase og lipid. Når colipase binder, aktiv lipase er stabilisert for hydrofobe interaksjon med triacylglycerides . Uten colipase til stede, akkumulering av amphiphiles på olje/vann-grensesnittet i tolvfingertarmen ville forhindre bukspyttkjertel lipase fra binding til underlaget. . Colipase og lipase er motsatt av det aktive området på C-terminal (kontakter regioner av rosa og gul, med vannmolekyler som vist i mørk blå). Enzymer er bundet av polare interaksjoner som , og .,
I nærvær av colipase, enzymet er aktivert som flytter (vist i rødt, aktive området i grønt) som består av aminosyrer 216-239. N-terminal klaff beveger seg i en samordnet mote sammen med C-terminal domene for å avsløre den aktive siden (grønn), slik at det å binde seg med et substrat. Det er en hypotese om at denne fleksibiliteten kan ha betydning i bindende colipase-lipase kompleks med vann-lipid-grensesnitt. Omorganiseringen av klaffen også induserer en annen conformational endring som skaper oxyanion hull.,
Lipase Katalytisk Mekanisme
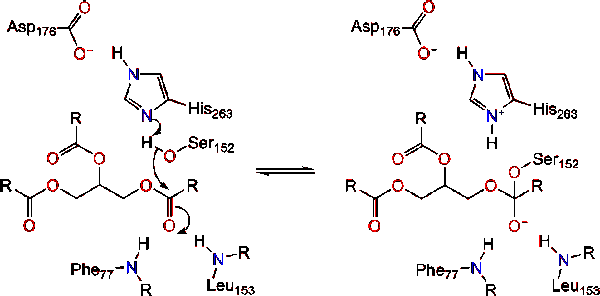
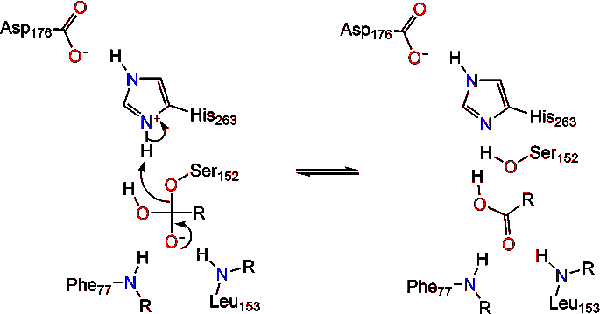
Lipase aktivering på lipid-vann-grensesnitt av triacylglycerides, i nærvær av colipase og galle salter, er kjent som interfacial aktivering. For hydroloysis reaksjonen skal finne sted, colipase ankere lipase lipid-vann-membran av micelle som fører til en overflate endre på lipase. Colipase fire hydrofobe looper samhandle med hydrofobe atmosfære av triacylglyceride. Dette starter aktive nettstedet binding til lipid, og åpne lokket for å få fram en mer hydrofobe miljø for triacylglycerol., Dette i sin tur gjør at triacylglycerol til å samhandle med-tasten aktive nettstedet rester som den katalytisk triade. Et variert utvalg av lipase enzymer som kan bli funnet i naturen. Om ulike former okkupere forskjellige protein stillaser, de fleste er bygd på en alpha/beta hydrolase brett og har en chymotrypsin-som består av sure rester, en histidin, og en serin nucleophile. I tilfelle av hest i bukspyttkjertelen lipase, katalytisk triaden består av . Dette katalytisk triade funksjoner som de fleste finnes i naturen., Første, asparaginsyre danner en hydrogen bindinger med Sin 263, øke pKa av histidin imidazole nitrogen. Dette gjør at histidin til å fungere som en kraftig generell base og deprotonate den serin. Den deprotonated serin så kan tjene som en nucleophile og angripe ester karbonyl av en av fettsyrer på 1 eller 3 karbonatomer av glyserol ryggraden i lipid-substrat. Ved å angripe lipid, et negativt ladet tetrahedral mellomliggende er dannet (Reaksjon 1). Det er stabilisert i oxyanion hullet ved to reststoffer: .,
– >
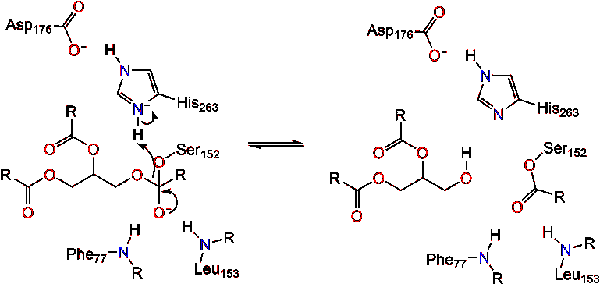
karbonyl reformer med glyserol ryggraden segmentet fungerer som forlater gruppen (Reaksjon 2).
– >
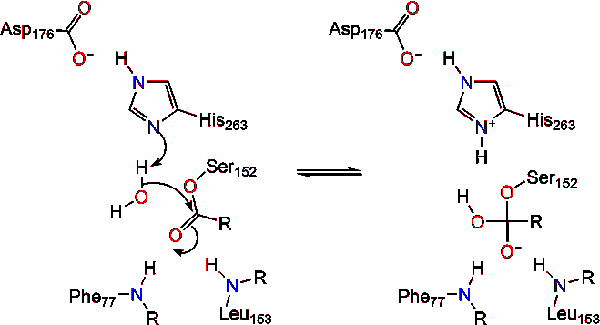
Et vann molekylet donerer et proton til histidin, skape en reaktiv hydroksyl-anion. Den hydroksyl-anion kan deretter angripe karbonyl karbon av lipid, og dannet en annen negativt ladet tetrahedral mellomliggende som er stabilisert i oxyanion hull (Reaksjon 3).,
– >
Ved reformasjonen av karbonyl, den katalytisk serin er utgitt, og monoglyceride og fettsyrer monomers diffuse unna (Reaksjon 4).
– >
Hemming av Bukspyttkjertelen Lipase
(lilla), C11 alkyl phosphonate, er en konkurransedyktig inhibitor av bukspyttkjertelen lipase. Det binder seg direkte i den aktive nettstedet lomme. Det er også fem B-octylglucoside (grå og rød) molekyler, som forbinder med lipase., MUP former hydrogen obligasjoner med : D 152 og Hans 263, som er en del av katalytisk triade, og Phe 77 og Leu 153 som er den stabiliserende rester ligger i oxyanion hull .MUP ble vist å være av van der Waals kontakter med hydrofobe sidekjeder Ala 178, Phe 215, Pro l80, Tyr ll4, Leu 213 (vist i blått).
Protein – Substrat Vekselsvirkningene
Lipase binder seg med mange hydrofobe kontakter. Som er sett her, lipase i samspill med alkyl gruppe av cholesteryl linoleate via et hydrofobt splittelsen innen protein., Dette rift orients molekylet for å optimalisere lipolyse reaksjon.
det Vises i denne scenen er lipase fra gjær Candida rugosa i med to molekyler av cholesteryl linoleate (grå). Det aktive nettstedet rester inkludert Ser152, Asp176, og His263 er vist i rødt stick representasjon. Lipase rommer to lipid-molekyler på grunn av det faktum at det er to identiske underenhetene katalysere en identisk reaksjon. En lipase-molekylet kan katalysere to lipolyse reaksjoner på en gang.,
Klinisk Signifikans
Bukspyttkjertelen lipase skilles ut i duodenum gjennom kanalsystemet i bukspyttkjertelen. I en sunn person, det er i svært lav konsentrasjon i serum. Under ekstreme forstyrrelser av bukspyttkjertelen funksjon, for eksempel pankreatitt eller kreft i bukspyttkjertelen, bukspyttkjertel kan begynne å fordøye seg selv og slipp bukspyttkjertelen enzymer inkludert i bukspyttkjertelen lipase i serum. Måling av serum-konsentrasjon av bukspyttkjertelen lipase kan derfor hjelp i diagnostisering av akutt pankreatitt.., På grunn av lipase aktivitet i fordøyelsen og absorpsjon av fett, har det vært en voksende markedet for lipase-hemmere for vekttap legemidler. De mest populære er Orlistat (Xenical eller®), som er et naturlig produkt fra Streptomyces toxytricini og er hydrogenering produkt av lipostation – en irreversibel lipase-hemmer. Dette hemmer også virker ved å binde Ser152, produsere en ester som hydrolyzes så sakte at det er praktisk talt irreversible .
3D-Strukturer av Lipase
Lipase 3D-Strukturer