Lewis struktur av vann molekylet inneholder to enkle obligasjoner rundt oksygen atom. totalt antall valence elektroner til oksygen og hydrogen atomer er brukt til å trekke lewis struktur. Hvert trinn av tegning lewis struktur av H2O er forklart i denne veiledningen.
H2O lewis struktur
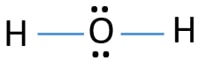
I lewis struktur av H2O, det er to enkle obligasjoner rundt oksygen atom. Hydrogen atomer er felles for oksygen atom gjennom single obligasjoner. Også, det er to ensomme par på oksygen atom.,
Vann molekylet er et enkelt molekyl. Tegning lewis struktur av molekyl vann er enkel enn noen av de andre komplekse molekyler eller ioner. Tenk deg tegning lewis struktur av thiosulfate ion.
Trinnene for å trekke lewis struktur av H2O
Det er noen trinn du må følge for å tegne et lewis struktur på riktig måte. For H2O-molekylene, sin lewis struktur og de trinnene er forklart i detalj i denne opplæringen. Fordi vann molekylet er enkle, noen av disse trinnene er ikke mye brukt. I slike tilfeller, de er nevnt med respektive trinn.,
- Finne totalt antall elektroner av valance skall av hydrogen atomer og oksygen atom
- Totalt elektroner par som enslig par og obligasjoner
- Center atom utvalget
- merk enslig par på atomer
- Merk kostnader på atomer hvis det finnes.
- Kontroller stabilitet og minimere kostnader på atomer ved å konvertere enslig par til obligasjoner for å få best lewis struktur.
Viktig: Tegning riktig lewis struktur er viktig å trekke resonans strukturer på riktig måte.,
Totalt antall elektroner av valance skall av H2O
Det er to elementer; hydrogen og oksygen. Hydrogen er en gruppe IA-elementet, og har bare ett elektron i sitt siste shell (valence shell). Oksygen er en gruppe VIA element i den periodiske tabell, og inneholder seks elektroner i sitt siste shell. Nå vet vi hvor mange elektroner har i valence skall av hvert atom.,
- valence elektroner gitt av hydrogen atomer = 1 * 2 = 2
- valence elektroner gitt av oksygen atomer = 6*1 = 6
- Totalt valence elektroner = 2 + 6 = 8
Totalt valence elektroner par
Totale valance elektroner par = σ obligasjoner + π obligasjoner + enslig par i valence skjell
Totale electron parene bestemmes ved å dividere antall totalt valence av to elektroner. For, H2O, Total par av elektroner er 4 i sin valence skjell.,
Center atom av H2O
Å være sentrum atom, evnen til å ha større valance er viktig. Deretter, fra hydrogen og oksygen, som atom har den høyeste valence? Maksimal valence av oksygen er to. hydrogen er bare valence er ett. Derfor, oksygen atom bør være sentrum atom av H2O. Nå, kan vi tegne en skisse av H2O for å vise hvordan atomene er plassert i molekylet.
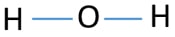
Enslig par på atomer
Etter å bestemme center atom og skisse av H2O-molekylene, vi bør begynne å merke enslig par på atomer., Husk at det er totalt fire electron par.
- Det er allerede to H-O obligasjoner i tegnet skisse struktur. Nå er det bare to (4-2) electron par som er igjen å markere på atomer.
- Vanligvis, de resterende electron par bør være i gang for å merke på utsiden atomer. Men i H2O, hydrogenatom er utenfor atomer som ikke kan holde mer enn to elektroner i sitt siste shell. Derfor kan vi markere disse to elektroner par på hydrogen atomer.,
- Så, markere disse to elektroner par på midten atom; oksygen

Merk kostnader på atomer
Det er ingen gebyrer på oksygen atom-og hydrogenatomer.
Se stabilitet og minimere kostnader på atomer ved å konvertere enslig par til obligasjoner
Fordi det er ingen gebyrer på atomer, ingen behov for å redusere kostnader som et skritt av tegning beste lewis struktur. Allerede, vi fikk den beste lewis-struktur for H2O.
Spørsmål
Hva er lignende lewis strukturer, slik at vann kan bli trukket for?,
I lewis struktur av molekyl vann, det er to sigma obligasjoner og to ensomme par rundt sulfuratom. Hydrogensulfid, oksygen difluoride (F2O) har lignende lewis strukturer til vann.
Spør din kjemi spørsmål og finne svar
i Slekt Tutorials