Den svært organiserte strukturer av proteiner er virkelig mesterverk av kjemiske arkitektur. Men svært organiserte strukturer en tendens til å ha en viss delikatesse, og dette er sant av proteiner. Denaturering er betegnelsen som brukes for noen endring i den tredimensjonale strukturen til et protein som gjør det ute av stand til å utføre sine tildelte funksjon. En denaturert protein ikke kan gjøre jobben sin. (Noen ganger denaturering er likestilles med nedbør eller koagulering av et protein; vår definisjon er litt bredere.,) Et bredt utvalg av reagenser og betingelser, som for eksempel varme, organiske forbindelser, pH-endringer, og heavy metal-ioner kan føre til protein denaturering.
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
Bruk av organiske forbindelser, som for eksempel etylalkohol |
Disse forbindelsene er i stand til å engasjere seg i intermolecular hydrogenbinding med protein molekyler, forstyrre intramolecular hydrogenbinding i protein., |
|
Salter av heavy metal-ioner, som for eksempel kvikksølv, sølv og bly |
Disse ionene form for sterke bånd med kaliumcarboxylaat anioner av den sure aminosyrer eller SH-grupper av cystein, forstyrre ioniske bindinger og disulfide sammenhengene. |
|
Alkaloid reagenser, for eksempel garvesyre (brukt i garving av skinn) |
Disse reagensene kombinere med positivt ladet amino grupper i proteiner for å forstyrre ioniske bindinger., |
Noen som har stekt et egg har observert denaturering. Den klare eggehvite blir ugjennomsiktig som albumin denatures og koagulerer. Ingen har ennå reversert at prosessen. Imidlertid, gitt de riktige omstendigheter og nok tid, et protein som har utfoldet seg under tilstrekkelig skånsom forhold kan refold og kan igjen vise biologisk aktivitet (Figur 2.5.1). Slike bevis antyder at, i det minste for disse proteinene, den primære strukturen bestemmer sekundær og tertiær struktur., En gitt sekvens av aminosyrer ser ut til å vedta sitt bestemt tre-dimensjonale (3D) arrangement naturlig hvis forholdene ligger til rette.
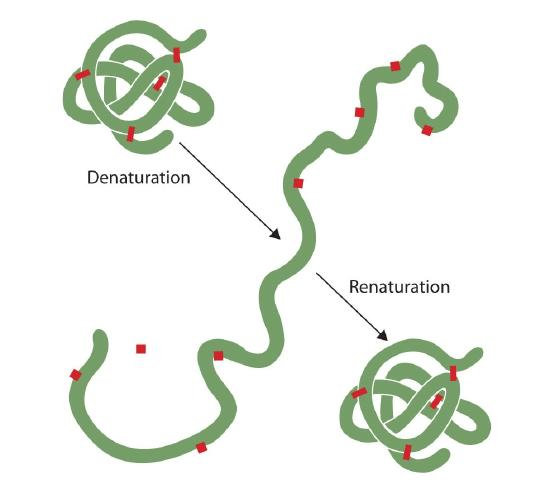
Den primære strukturer av proteiner er ganske solid., Generelt, er ganske sprek betingelser er nødvendig for å hydrolyze peptid obligasjoner. På videregående gjennom kvartær nivåer, men proteiner er ganske sårbare for angrep, selv om de varierer i deres sårbarhet for denaturering. Den delikat kastet globular proteiner er mye lettere å denaturering enn er tøff, fibrøse proteiner av hår og hud.
Oppsummering
Proteiner kan deles inn i to kategorier: fibrøs, som har en tendens til å være ikke oppløselig i vann, og globular, som er mer løselig i vann. Et protein kan ha opp til fire nivåer av strukturen., Den primære strukturen består av spesifikke aminosyre-sekvensen. Den resulterende peptid-kjeden kan danne en α-helix-eller β-pleated-ark (eller lokale strukturer ikke så lett å kategorisere), som er kjent som sekundær struktur. Disse segmentene av sekundær struktur er innlemmet i tertiær struktur på brettet polypeptid-kjeden. Den kvartalsvise struktur beskriver ordninger av underenhetene i et protein som inneholder mer enn ett subunit., Fire hovedtyper av attraktive vekselsvirkningene bestemme form og stabilitet av brettet protein: ionisk binding, hydrogenbinding, disulfide forbindelser, og spredning styrker. Et bredt utvalg av reagenser og forhold kan føre til at et protein til å utfolde seg eller denaturering.