고도로 조직된 구조의 단백질은 진정으로 마스트의 화학공합니다. 그러나 고도로 조직화 된 구조는 특정 섬세함을 갖는 경향이 있으며 이것은 단백질에 해당됩니다. 변성은 할당 된 기능을 수행 할 수 없게 만드는 단백질의 3 차원 구조의 모든 변화에 사용되는 용어입니다. 변성 된 단백질은 그 일을 할 수 없습니다. (때로는 변성과 동일시 강수량 또는 응집의 단백질이다;우리의 정의는 조금 더 넓다.,)열,유기 화합물,pH 변화 및 중금속 이온과 같은 다양한 시약 및 조건은 단백질 변성을 일으킬 수 있습니다.
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
의 사용은 유기 화합물과 같은 에틸알코올 |
이러한 화합물이 할 수있는 매력적인 분자간에 수소 결합 단백질 분자,방해 intramolecular 수소 결합 내에서 단백질이다., |
|
의 염 무거운 금속이온,수은 등의 실버,그리고로 이어질 |
이러한 이온에 강한 유대를 형성 카복실산과 음이온의 산성 아미노산 또는 SH 그룹의 시스테인,방해 이오니아의 채권 및 이황화 연계됩니다. |
|
알칼로이드의 시약과 같은 타닌산(에서 사용되는 선탠 가죽) |
이러한 시약을 결합으로 긍정적으로 부과 아미노 그룹에서 단백질을 방해하는 이온 수 있습니다., |
누군가는 튀김 달걀은 관찰된 변성. 알부민이 변성되고 응고됨에 따라 맑은 달걀 흰자위가 불투명 해집니다. 아무도 아직 그 과정을 뒤집지 않았습니다. 그러나,주어진 상황과 시간이 충분한 단백질로 전개하고 있습니다 밑에 충분히 부드러운 조건 수 있습 refold 및 수 있습 다시 전시회 생물학적 활동(그림 2.5.1). 그러한 증거는 적어도 이들 단백질에 대해 1 차 구조가 2 차 및 3 차 구조를 결정한다는 것을 시사한다., 아미노산의 주어진 순서는 조건이 맞으면 자연적으로 그것의 특정한 3 차원(3D)배열을 채택하는 것을 보인다.
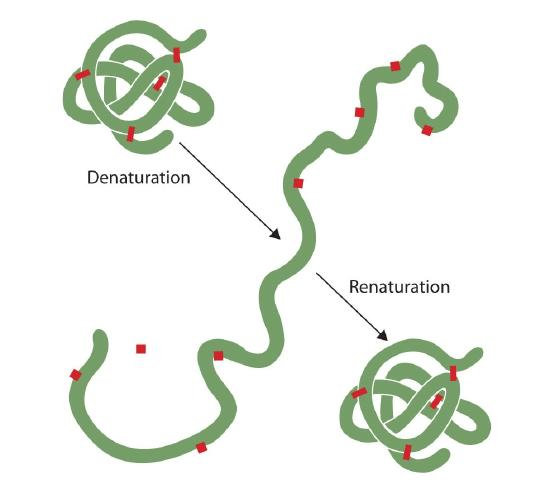
단백질의 기본 구조는 매우 견고합니다., 일반적으로 펩타이드 결합을 가수 분해하기 위해서는 상당히 활발한 조건이 필요합니다. 그러나 2 차 내지 4 차 수준에서 단백질은 변성에 대한 취약성이 다양하지만 공격에 매우 취약합니다. 섬세하게 접힌 구형 단백질은 머리카락과 피부의 거친 섬유질 단백질보다 변성하기가 훨씬 쉽습니다.
요약
단백질은 두 가지로 나눌 수 있습니다 카테고리:섬유,경향이 있는 것에 불용성 물,공 모양,는 수용성에서는 물. 단백질은 최대 4 가지 수준의 구조를 가질 수 있습니다., 기본 구조는 특정 아미노산 서열로 구성됩니다. 결과 펩타이드 체인을 형성할 수 있습 α-helix 또는 β-내기 시트(또는 로컬 하지 않는 구조로 쉽게 분류)으로 알려진 보조 구조입니다. 2 차 구조의 이들 세그먼트는 접힌 폴리펩티드 사슬의 3 차 구조에 통합된다. 4 차 구조는 하나 이상의 서브 유닛을 포함하는 단백질에서 서브 유닛의 배열을 설명합니다., 네 가지 주요 형태의 매력적인 상호 작용을 결정하는 모양의 안정성 접힌 단백질:이온 결합,수소결합,이황화물 결합,분산을 힘입니다. 다양한 시약 및 조건으로 인해 단백질이 전개되거나 변성 될 수 있습니다.