이온이란?
이온은 전기 전하를 운반하는 원자 또는 분자입니다.
이온은 전기 전하의 부호와 크기를 보여주기 위해 위 첨자를 사용하여 식별됩니다.
음이온 및 양이온
부정적인 이온 이라고 음이온,그리고 긍정적으로 양이온이라고 양이온.,n 원자 이익 세 개의 전자가 N3-
의 예에는 양이온
- 나트륨 원자 잃은 전자가 Na+
- 마그네슘 원자 잃는 두 개의 전자가 Mg2+
- 철 원자를 잃는 세 개의 전자가 Fe3+
- 물과 반응하 H+을 형성하는 분자 양이온 H3O+
이온성
이온 양식을 할 때 그렇게 하면 최소화하는 총 에너지의 화학종에 관련된 화학 반응입니다.,종종 이것은 다른 원소의 원자가 전자의 전체 껍질을 달성 할 수있게함으로써 달성됩니다.
을 고려 소금 리튬 불소:
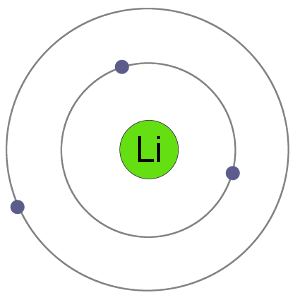
리튬 원자가 3 전자,의미들이 전자에서 두 개의 껍질:2 에서 첫 번째 쉘에서는 1second.By 을 잃고자 하되 양이온,리튬을 얻는 안정적인 전자 배열을,그것과 동일한의 고귀한 가스 헬륨입니다.,
리 Atom
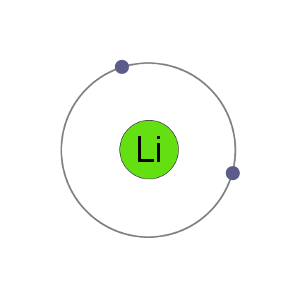
리+양이온
불소 원자는 9 전자는 의미,그들은 2 에서 첫 번째 쉘에서 7second.By 오 전자되는 음이온 불화물 이온을 가져옵 안정적인 전자,배열 는 것과 동일하의 고귀한 가스 neon.,”e9c2d99c83″>
고 그래서 산화환원 반응의 나트륨 염소와 양이온성 화합물은 정력적으로 유리한다.
의 감소 chlorine:Cl2+2e-→2Cl-
전체적인 반응:2Na+Cl2→2NaCl
이온 크기
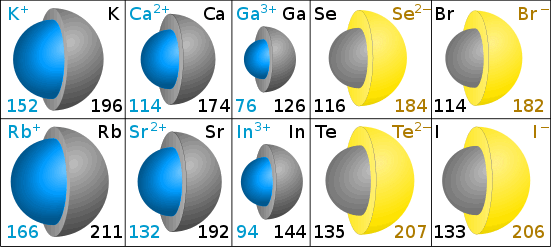
양이온보다 작은 원 원자-는 방법을 고려 나트륨 원자는 전자서 세 개의 껍질 는 나트륨이온은 전자서 두개입니다.,전자가 많을수록 음이온은 원래 원자보다 큽니다.
이온 크기는 이온 반경에 의해 측정됩니다.
피코 미터의 이온 반경
다이어그램의 회색 색상은 원래 원자의 크기를 보여줍니다. 청색(양이온)과 황색(음이온)은 이온의 크기를 나타낸다. (크리스 킹에 의해 다이어그램.)

이온화합물
이온화합물과 같은 염화나트륨(NaCl)을 형성하기 때문에 정전기 매력 간의 음이온 및 양이온.,이온 성 화합물은 양전하의 총 수와 음전하의 총 수가 항상 같기 때문에 전기적으로 중성입니다.
고려하고 화학적 요소,장을 형성하는 경향이온성 화합물에 존재하는 적어도 음전기금속과 대부분의 음 비금속.
전기도체
이온 수행할 수 있습;전류 관찰할 수 있습에서 전기화학 세포,그리고 플라즈마에서,예를 들어.
에서는 일반,고체 화합물 이온 수행하지 않는 전류가 있기 때문에,이온은 잠에서 고정된 위치에서 결정 격자입니다.,이온 성 화합물은 용융 될 때 또는 용액에 용해 될 때 이온이 결정 격자에서 방출되어 이동성이 될 때만 전기를 전도합니다.