칼륨 황화로 표시되는 화학식 K2S 화합물의 칼륨 황 알맞게 수용성에산입니다. 그것은 조해성이며 공기 중에 자발적으로 발화 될 수 있습니다. 그것은 환원제 및 이온 화합물입니다.

칼륨 황화
Composition 및 합성
칼륨 황화해서 준비될 수 있는 첫 번째 치료 수산화 칼륨을 초과 황화수소를 형성 칼륨 hydrosulfide(KHS)., 같은 양의 수산화 칼륨으로 KHS 를 추가로 처리하면 황화 칼륨이 생성됩니다.,H2S = KHS + H2O
KHS + KOH = K2S + H2O

Potassium Sulfide Formula
Properties and Characteristics of Potassium Sulfide
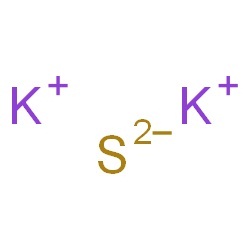
Potassium Sulfide Structure
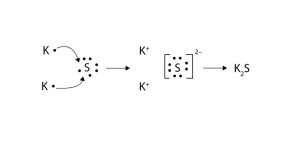
Lewis Dot Structure for Potassium Sulfide
Prominent Reactions of K2S
Potassium sulfide reacts with cobalt iii bromide to produce cobalt iii sulfide and potassium bromide .,
3K2S+2CoBr3=Co2S3+6KBr
칼륨 황화수소와 반응하여 희석한 염산하는 생산 염화칼륨 황화수소.
K2S+2HCl=2KCl+H2S
반응으로 집중 황산 칼륨 bisulfate,황산,황 및 물
K2S+3H2SO4=2KHSO4+SO2+S+2H20
화합물과 반응하여 질산은 형성하는 수용성 칼륨 질산 은 황화물 침전물.
k2s+2AgNO3=2KNO3+Ag2S
황화 칼륨은 불꽃에서
- 를 사용합니다.
- .,<리>제모 및 약으로.
분석 화학의 시약으로
위험합니까
화재 위험이 발생할 수 있으므로 공기와 접촉하지 않도록 예방 조치를 취해야합니다. 분말 또는 먼지의 형태로 폭발적입니다. 섭취,흡입 및 피부 접촉은 심각한 부상 및 심지어 사망을 초래할 수 있습니다. 또한 눈과 피부에 해를 끼치며 눈 손상과 피부 화상을 유발합니다. 따라서 모든 접촉을 피해야합니다. 그것은 분해에 가열하는 경우에 유독한 증기를 방출합니다. 그것은 부식성 성질이며 환경에 유독합니다.
- 황화 칼륨-Americanelements.,com
- 칼륨 Sulfida–Chemspider.com
- 칼륨 Sulfida–Pubchem.ncbi.nlm.nih.gov
- 칼륨 Sulfida–Chemicalbook.com
- 이 K2S 산성 또는 기본? –Quora.com
- 디포타슘 설피다–Webelements.com
- 칼륨 설피다의 용도는 무엇입니까? –Quora.com
- 칼륨 Sulfida–Merckmillipore.com
- 준비 칼륨의 sulfida–Prepchem.com
- 가용성 규칙 및 순 이오니아 방정식을 연습–Vincentianacademy.org
- 칼륨 sulfida 반응은 염화수소–Chemiday.,com
- Question #e42f1 – Socratic.org
- Potassium sulfide react with sulfuric acid – Chemiday.com