루이스의 구조 물 분자를 포함 두 단일채의 주위에 산소 원자입니다. 산소와 수소 원자의 총 원자가 전자의 수는 루이스 구조를 그리는 데 사용됩니다. H2o 의 루이스 구조를 그리는 각 단계는이 자습서에서 설명합니다.
H2O 루이스 구조
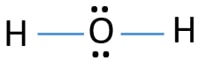
에서 루이스의 구조 H2O,두 가지가 있는 단일채의 주위에 산소 원자입니다. 수소 원자는 단일 결합을 통해 산소 원자와 공동입니다. 또한 산소 원자에 두 개의 고독한 쌍이 있습니다.,물 분자는 간단한 분자입니다. 물 분자의 루이스 구조를 그리는 것은 다른 복잡한 분자 또는 이온 중 일부보다 간단합니다. 티오 황산염 이온의 루이스 구조를 그리는 것을 상상해보십시오.
h2o 의 루이스 구조를 그리는 단계
루이스 구조를 적절히 그리기 위해 따라야 할 몇 가지 단계가 있습니다. H2O 분자의 경우 루이스 구조와 그 단계는이 튜토리얼에서 자세히 설명합니다. 물 분자는 간단하기 때문에 이러한 단계 중 일부는 많이 사용되지 않습니다. 그러한 경우에는 각각의 단계와 함께 언급됩니다.,
- 찾아의 총 수,전자의 밸런스 조개의 수소 원자,산소 원자
- 총 전자 쌍으로 외로운 쌍 및 채권
- Center 원자 선택
- 마크 론 쌍에 원자
- 마크 요금에 원자이 있는 경우.
- 체크인 안정성을 최소화 요금에 원자로 변환하여 고독한 쌍이하여 채권을 획득 최고의 루이스는 구조입니다.
중요:올바른 루이스 구조를 그리는 것은 공명 구조를 올바르게 그리는 데 중요합니다.,
h2o 의 원자가 껍질의 총 전자 수
원소의 두 가지가 있습니다;수소와 산소. 수소는 그룹 IA 원소이며 마지막 껍질(원자가 껍질)에 하나의 전자 만 있습니다. 산소는 주기율표의 원소를 통해 그룹이며 마지막 껍질에 6 개의 전자를 포함합니다. 이제 우리는 각 원자의 원자가 껍질에 얼마나 많은 전자가 포함되어 있는지 알고 있습니다.,
- 원자의 전자에 의해 주어진 수소 원자=1*2=2
- 원자의 전자에 의해 주어진 산소 원자=6*1=6
- 총 원자의 전자=2+6=8
총 원자의 전자 쌍
총 밸런스 전자 쌍= σ 채권+π 채권+외로운 쌍에는 원자탄
전체 전자쌍을 결정할 수는 총 원자의 전자에 의해 두. 들어,H2O,전자의 총 쌍은 원자가 껍질에 4 입니다.,
H2o 의 중심 원자
중심 원자가되기 위해서는 더 큰 원자를 갖는 능력이 중요합니다. 그렇다면 수소와 산소로부터 어떤 원자가 가장 높은 원자가 있습니까? 산소의 최대 원자는 두 가지입니다. 수소의 유일한 원자는 하나입니다. 따라서,산소 원자 중심에 원자의 H2O. 지금,우리가 할 수 있습의 스케치를 그려 H2O 는 방법을 보여 원자가에 위치한 분자입니다.
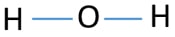
고독한 쌍에 원자
후 결정하는 중심 원자와 스케치의 H2O 분자,우리가 시작해야 하는 표시하는 외로운 쌍에서 원자를 함유하고 있습니다., 총 4 개의 전자쌍이 있다는 것을 기억하십시오.
- 그려진 스케치 구조에는 이미 두 개의 H-O 결합이 있습니다. 이제 원자에 표시하기 위해 두 개의(4-2)전자쌍 만 남아 있습니다.
- 일반적으로 나머지 전자쌍은 외부 원자에 표시하기 시작해야합니다. 그러나 H2O 에서 수소 원자는 마지막 껍질에 2 개 이상의 전자를 유지할 수없는 외부 원자입니다. 따라서 우리는 수소 원자에 그 두 전자 쌍을 표시 할 수 없습니다.,
- 그리고,그 표시를 두 개의 전자에 쌍을 중심 원자 산소

마크 요금에 원자
가 요금이 부과되지 않에 산소 원자와 수소 원자를 함유하고 있습니다.
체크인 안정성을 최소화 요금에 원자로 변환하여 고독한 쌍이하여 채권
이 없기 때문에 요금 원자로,필요를 감소 요금의 한 단계로 그리고 최고의 루이스는 구조입니다. 이미 우리는 최고의 루이스 구조에 대한 H2O.
질문
은 어떤 것인 루이스 구조 물을 그릴 수 있습니까?,
물 분자의 루이스 구조에서 sulfuratom 주위에 두 개의 시그마 결합과 두 개의 고독한 쌍이있다. 황화수소,산소 difluoride(F2O)물 비슷한 루이스 구조.
화학 질문을하고 답을 찾으십시오
관련 자습서