タンパク質の高度に組織化された構造は、本当に化学アーキテクチャの傑作です。 しかし、高度に組織化された構造は、特定の繊細さを持つ傾向があり、これはタンパク質の真実です。 変性は、タンパク質の三次元構造の変化に使用される用語であり、その割り当てられた機能を実行することができない。 変性タンパク質はその仕事をすることはできません。 (時には変性は、タンパク質の沈殿または凝固と同一視される;我々の定義は少し広いです。, 熱、有機化合物、pH変化、重金属イオンなど、さまざまな試薬や条件がタンパク質変性を引き起こす可能性があります。
|
Method |
Effect on Protein Structure |
|---|---|
|
Heat above 50°C or ultraviolet (UV) radiation |
Heat or UV radiation supplies kinetic energy to protein molecules, causing their atoms to vibrate more rapidly and disrupting relatively weak hydrogen bonding and dispersion forces., |
|
エチルアルコールなどの有機化合物の使用 |
これらの化合物は、タンパク質分子と分子間水素結合に関与し、タンパク質内の分子内水素結合を破壊することができる。, |
|
水銀、銀、鉛などの重金属イオンの塩 |
これらのイオンは、酸性アミノ酸またはシステインのSH基のカルボキシレートアニオンと強い結合を形成し、イオン結合およびジスルフィド結合を破壊する。 |
|
タンニン酸などのアルカロイド試薬(なめし革に使用) |
これらの試薬は、タンパク質中の正に荷電したアミノ基と結合してイオン結合を破壊する。, |
卵を揚げた人は誰でも変性を観察しました。 明確な卵白はアルブミンが変性し、凝固すると同時に不透明に回ります。 誰もまだそのプロセスを逆転させていない。 しかし、適切な状況と十分な時間を考えると、十分に穏やかな条件下で展開したタンパク質は再び折り畳まれ、再び生物学的活性を示す可能性がある(図2.5.1)。 などを踏まえると、少なくともこれらのタンパク質の一次構造を決定二次、三次構造。, 与えられたアミノ酸配列は、条件が正しければ、その特定の三次元(3D)配置を自然に採用するようです。
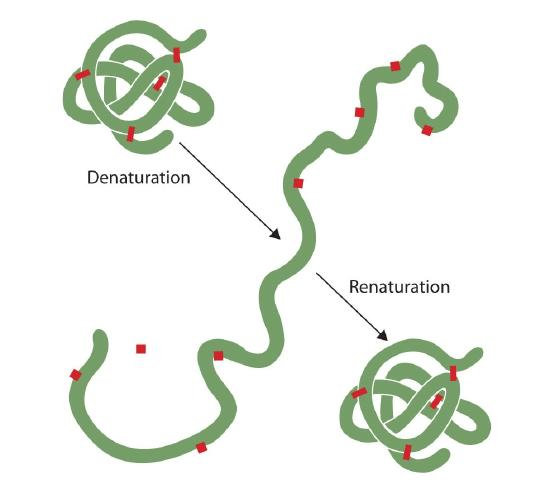
タンパク質の一次構造は非常に頑丈です。, 一般に、ペプチド結合を加水分解するためにはかなり激しい条件が必要である。 しかし、二次から四次レベルでは、タンパク質は変性に対する脆弱性が異なるものの、攻撃に対して非常に脆弱である。 繊細に折り畳まれた球状タンパク質は、髪や肌の丈夫で繊維状のタンパク質よりも変性がはるかに簡単です。
概要
タンパク質は、水に不溶性である傾向がある繊維状と、水に可溶性である球状の二つのカテゴリーに分けることができます。 タンパク質合へのさまざまな取り組みレベルの構造です。, 一次構造は、特定のアミノ酸配列からなる。 得られたペプチド鎖は、二次構造として知られているα-ヘリックスまたはβ-プリーツシート(または容易に分類されない局所構造)を形成することができる。 これらの二次構造の部分は折り畳まれたポリペプチド鎖の三次構造に組み込まれる。 四次構造は、複数のサブユニットを含むタンパク質中のサブユニットの配列を記述する。, イオン結合、水素結合、ジスルフィド結合、および分散力:引力相互作用の四つの主要なタイプは、折り畳まれたタンパク質の形状と安定性を決定します。 多種多様な試薬および条件により、タンパク質が展開または変性する可能性があります。