図4.1(拡大図参照)
したがって、このシナプスを理解することは他のものを理解することにつながる。 したがって、我々はまず、骨格神経筋接合部におけるシナプス伝達のプロセスを議論します。,
神経筋接合部におけるシナプス接合の特徴を左図に示す。 骨格筋線維は、その細胞体が脊髄の腹角に位置する運動ニューロンによって神経支配される。 軸索の末端領域は、骨格筋細胞に沿って走る非常に細かいプロセスを生じさせる。 に沿ってこれらの工程は、専門の構造とシナプ 脊髄運動ニューロンと骨格筋細胞との間に作られる特定のシナプスは、その特定の構造のために運動エンドプレートと呼ばれる。,
神経筋接合部のシナプスは、神経系における化学シナプスの三つの特徴を有する。 まず、シナプス前膜とシナプス後膜の間には明確な分離があります。 両者の間の空間は、シナプス裂として知られています。 このスペースは、シナプス裂を横切る情報の流れを持つためには、シナプス前ニューロンとシナプス後ニューロンの間にいくつかの仲介シグナル伝達機構がなければならないことを示している。 第二に、小さな球状小胞の特徴的な高密度がある。, これらのシナプス小胞には神経伝達物質物質が含まれています。 シナプスはまた、ミトコンドリアの高密度に関連付けられています。 第三に、ほとんどの場合、シナプス後膜の特徴的な肥厚があり、少なくとも部分的には、シナプス後膜がシナプス前ニューロンから放出される化学送信物質に結合する特殊な受容体の高密度を有するという事実に起因する。 シナプス接合の形態学的特徴に関する追加の詳細は、第8章および第10章に記載されている。
4.,2神経筋接合部におけるシナプス伝達の生理
図4.2
右の図は、骨格神経筋接合部におけるシナプス伝達の生理をどのように詳細に研究することができるかを非常に概略的に示している。 筋肉とその付着した神経の一部を、適切なリンガー溶液で満たされた小さな実験室内に置く。 筋肉細胞の休息電位は、微小電極で記録される。 電極はまた、神経軸索の表面上に配置される。, 短い電気ショックは、シナプス末端に伝播する活動電位が開始される原因となります。
以下の図は、このような単離された神経筋調製物において記録された二つのタイプの潜在的な変化を示している。 この実験はまた、骨格神経筋接合部におけるシナプス伝達の過程を研究するのに非常に有用であることが証明されている強力な薬物、curareの特性を示 パートAは、運動軸索を刺激した結果として筋肉細胞に記録される潜在的な変化の順序を示す。, 矢印は、衝撃がモータ軸索に送達される時点を示す。 ショック後の静止時間があることに注意してください。 この遅延は、運動軸索における活動電位がその開始部位から伝播するのにかかる時間によるものである。 遅延後、筋細胞に記録された電位の二つのタイプがあります。 まず、以下の議論の焦点となる比較的ゆっくりと変化する可能性があります。, その遅い初期電位が十分に大きい場合、それは通常、骨格筋細胞にあるように、第二の電位、活動電位は、筋肉細胞に誘発されます。
図4.3
骨格筋細胞における活動電位は、以前に議論したものと同様のイオン機構によるものである。 具体的には、Na+透磁率の電圧依存的変化に続いてK+透磁率の遅延した増加があります。 (ただし、平滑筋細胞と心筋細胞では、イオン機構は異なります。,)
活動電位を引き起こす根本的な出来事は、一部の南アメリカインディアンが使用する矢の毒であるcurareを利用することによって明らかにするこ 低用量のcurare(パートB)は、基礎となる事象を減少させるが、閾値を下回るまで十分に減少させられていない。 Curareの幾分高用量が送達される場合(パートC)、遅い基礎となる事象は閾値以下になる。 基礎となる信号は、モータのエンドプレートに記録される電位変化であるため、エンドプレート電位(EPP)と呼ばれます。 一般に、興奮性シナプス後電位(EPSP)として知られている。,
Curareは、シナプス前末端で放出される送信機であるアセチルコリン(ACh)の競合阻害剤であるため、エンドプレート電位をブロックする。 Curareは、電圧依存性Na+コンダクタンスまたは筋肉活動電位の根底にある電圧依存性K+コンダクタンスをブロックしません。 Curareは、通常、筋肉活動電位の開始につながる刺激(EPSP)に影響を与えます。 Curareで毒殺された動物は、呼吸筋における神経筋伝達のプロセスが妨げられるため、窒息するでしょう。,
通常、エンドプレートポテンシャルの大きさはかなり大きいです。 実際、エンドプレート電位の振幅は約50mVであるが、しきい値に達するのに必要なのは約30mVだけである。 余分な20mVは安全係数と呼ばれます。 したがって、疲労のためにエンドプレート電位がやや小さくなったとしても(例えば、振幅が40mV)、EPPは閾値に達し、運動軸索の活動電位と筋肉細胞の活動電位との間の一対一の関係は保存されるであろう。
図4.4
4.,3EPPの伝播
EPPの特性は何ですか、そしてそれは活動電位の特性とどのように比較されますか?
エンドプレート電位は、活動電位のようなNa+およびK+透過性の電圧依存的変化によるものですか?
エンドプレート電位は、活動電位のような全か無かの方法で伝播されますか?
左の図は、エンドプレートポテンシャルの伝播を調べる実験を示しています。 筋繊維は1mm間隔で電極で繰り返し突き刺される。, (この実験はcurareの低い集中の前で行われる従ってendplateの潜在性が活動電位の誘発の複雑化なしで記録することができるのでendplateの潜在性が小さいこと)エンドプレート電位は、全か無かの方法で伝播されません。 それは筋肉に沿って広がりますが、それは減少してそうします。, したがって、エンドプレート電位の開始部位から筋細胞に沿った他の部位への広がりは、軸索の一部のしきい値以下の電位変化が軸索に沿って広がるのと同じように、または金属棒上の一点の温度の変化が棒に沿って広がるのと同じように、受動的かつ減少して起こる。
4.4EPPの根底にあるイベントのシーケンスの概要
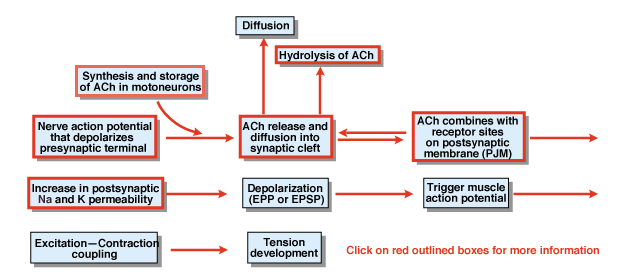
図4.5
化学シナプス伝達の過程における他のステップは何ですか? 図4.,5概要を説明します。 脊髄運動ニューロンの細胞体で開始される神経活動電位は、腹側根を伝播し、最終的に運動ニューロンのシナプス末端に侵入する。 活動電位の結果として、化学送信機のアセチルコリン(ACh)はシナプスの裂け目に解放されます。 AChはシナプスの裂け目を渡って拡散し、postsynapticまたはpostjunctional膜の特別な受容器に結合します。 その受容体へのAchの結合は、Na+およびK+の両方に特異的に透過性である膜チャネルにおける立体配座変化を生じる。, Na+およびK+透過性の増加の結果として、シナプス後膜の脱分極がある。 この脱分極は、エンドプレート電位またはより一般的にはEPSPと呼ばれます。 EPSPが十分に大きければ、通常は神経筋接合部にあるので、筋細胞における活動電位の開始をもたらす。 活動電位は、励起収縮結合および張力の発達のプロセスを開始する。 エンドプレート電位の持続時間は約10ミリ秒である。
二つの要因は、神経筋接合部におけるEPSPの持続時間を制御する。, まず、拡散によってAchを除去する。 第二に、アセチルコリンエステラーゼ(AChE)と呼ばれるシナプス裂の物質は、achを加水分解または分解する。 AChEは知られている最も効率的な酵素の一つです。 AChEの単一の分子は毎分AChの600,000分子を加水分解できます。
4.5AChEの役割
図4.6
ネオスチグミンである重要な物質ファミリーは、AChEの作用を阻害する。 Neostigmineは痛みの行為を妨げ、それにより持続期間でendplateの潜在性をより大きくそしてより長くさせます。, この図は、二つのエンドプレート電位を示し 一つは生理食塩水およびcurareに記録され、もう一つは溶液にネオスチグミンを添加した後に記録された。 (Curareはeppの特性が筋肉細胞の活動電位を誘発しないで調査することができるように加えられます。)Neostigmineを適用した後endplateの潜在性は持続期間で大いにより大きく、より長いです。
4.6A重症筋無力症
重症筋無力症は、筋細胞におけるアセチルコリン受容体の数の減少のために重度の筋力低下と関連している。, エンドプレート電位が小さい場合、エンドプレート電位はしきい値に達することができない。 それが閾値に達しなければ、筋肉細胞に活動電位がなく、筋肉の収縮がなく、筋肉の衰弱を引き起こす。 ネオスチグミンおよび他の痛みの阻害剤は、重症筋無力症の患者を治療するために使用される。 これらの薬剤は、より効果的に放出されるアセチルコリンの量を残りのアセチルコリン受容体に到達させる。
4.,6b神経剤
AChEの阻害剤は重要な治療的価値を有するが、いくつかの阻害剤は毒物として使用されており、依然として使用されている。 SomanおよびサリンのようなあるAChEの抑制剤はAChEのかなり不可逆的なブロックを形作ります。 このブロックはシナプスの裂け目のAChの極度なレベルの原因となります。 そのように毒殺された個人は、発作および呼吸筋を含む筋肉痙攣によって死ぬ。
図4.7
4.,7AChのイオントフォレシス
イオントフォレシスは、AChが神経筋接合部の神経伝達物質物質であるという仮説をさらにテストするために使用できる興味深い技術である。 Achがこのシナプスによって放出される送信機である場合、送信機の通常の放出のために送信機の人工的な適用を置き換えることが可能であるべきであると予測するであろう。 Achは正に荷電した分子であるので、シナプス前末端からのAchの放出をシミュレートするために微小電極から強制することができる。
図4.,8
確かに、微量のAChを神経筋接合部の近傍に適用することができる。 図4.8は、運動軸索の刺激によって生成されるEPPとAChの排出に対する応答を比較したものです。 電位変化はAchの通常の放出によって生成されるエンドプレート電位とほぼ同じに見える。 この実験は、AChがこのシナプスにおける自然な送信機であるという概念の実験的なサポートを提供する。,
AChの放出に対する応答は、骨格神経筋接合部におけるシナプスのコリン作動性性質とすべて一致するいくつかの他の興味深い特性を有する。 ネオスチグミンは、AChのイオントフォレシスに対する応答をより長く、より大きくする。 CurareはAChの正常な結合と競うので応答を減らします。 AChが筋肉細胞に出れば、アセチルコリンのための受容器が内部にないので何も起こりません;それらは筋肉細胞の外側にあります。, エンドプレートから離れた筋肉の領域へのアセチルコリンの適用は、AChの受容体がシナプス領域に集中しているため、応答を生じない。
これまでの理解をテストするために、TTXなどの薬剤がEPPの生成とAChのイオントフォレスティック適用に対する筋線維の応答の両方にどのように影響するかを検討してください。 TTXはAChに対する応答には影響しませんが、EPPをブロックします。 Achに対する応答が影響を受けない理由は明らかであるが、ここで効果がなければ、EPPにも影響がないはずであると多くの人が予想する。, 従ってTetrodotoxinは受容器にアセチルコリンの結合に影響を与えないし、AChの直接適用への応答に影響を与えません。 しかしながら、テトロドトキシンは、運動軸索において誘発される活動電位の能力に影響を及ぼすであろう。 運動軸索に活動電位を誘発できない場合、送信機の放出を引き起こすことはできない。 したがって、テトロドトキシンはEPPを完全に廃止するでしょう。 このブロックは、Ach受容体のブロックによるものではなく、むしろ、送信機の放出に先立つある段階のブロックによるものであろう。
4.,8EPPのイオンメカニズム
Bernard Katzらは、神経筋接合部におけるシナプス伝達のメカニズムを研究する先駆者であった。 彼らは、Achによって開かれたチャネルはNa+とK+の両方に等しい透過性を有するものであることを示唆した。 それはNa+とK+に等しく透過性であったので、Katzは、これらのチャネルの開口部の結果として、膜電位は0mVに向かって移動することを示唆した。 (GHK方程式におけるアルファの値は、式に代入されたときに約0mVの電位をもたらすものに等しい。,)
図4.9
左の図に示す実験は、その概念をテストします。 筋細胞は、記録電極と、人工的に膜電位を変化させるために適切な電位源に接続することができる別の電極で貫通されている。 通常、膜電位は再び-80mV程度であり、EPPが小さくなるように少量のcurareが添加される。 Katzはこれらの実験でEPPのサイズが筋肉細胞の潜在性によって劇的に変わることに気づいた。, 膜電位を0mVに移動すると、電位変化は一切記録されません。 膜電位を+30mVにすると、EPPは反転します。 だから三つの異なる刺激は、互いに非常に異なるエンドプレート電位を生成します。
電位が0mVのときの応答の欠如は特に有益です。 潜在的な変化が記録されない理由を検討してください。 おそらく、送信機は放出され、受容体に結合している。, 潜在的な変化の欠如についての簡単な説明は、Achチャネルの開放が到達しようとしている可能性が既に達成されていることである。 膜電位が0mVよりも正になると、EPPは反転されます。 どのような電位であっても、透過性の変化は膜電位を0mVに向かって移動させる傾向があります! 静止電位が0mVよりも負である場合、上向きのたわみがあります。 それがより肯定的であれば、下向きのたわみがあります。 すでに0mVにある場合、たわみはありません。
図4.,10
この電位は、シナプス電位の符号が反転する電位であるため、逆転電位とも呼ばれます。 この実験は、Achが受容体に結合する結果として、特異的チャネルがNa+およびK+に対して等しく透過性になることを示している。 この透過性の変化は、膜電位が最初にあるところから0mVの新しい電位に向かって移動する傾向があります。
通常のエンドプレート電位が実際に0mVに達しないのはなぜですか?, 一つの理由は、活動電位の根底にある透過性の変化のシーケンスがEPPによって生成された変化を”沼”ということです。 しかし、活動電位が引き起こされなかったとしても、EPPは依然として0mVに達しません。 これはAChチャネルが筋繊維のチャネルの総数のほんのわずかであるのであります。 筋肉細胞にその安静電位を与えるK+チャネルも同様に存在する。 彼らの仕事は、安静電位で細胞を維持しようとすることです。,
AChによって開かれたチャネルは、リガンドゲートチャネルまたはイオノトロピック受容体と呼ばれる一般的なクラスのチャネルのメンバーである。 図4.10に示すように、送信機結合部位はチャネル自体の一部である。 受容体へのトランスミッター結合の結果として(一般に二つの分子が必要である)、細孔領域が開き、イオンがそれらの電気化学的勾配を流れ落ちることを可能にするタンパク質における立体配座変化がある。 チャンネルの詳細については、第11章を参照してください。,
あなたの知識をテスト
- 質問1
- A
- B
- C
- D
骨格筋細胞におけるエンドプレート電位は、原理的には、以下のイオンのどれに対する透過性 (以下に列挙する各イオンに対する有限の初期透過性が存在し、生理学的濃度勾配が存在すると仮定する。):
A.Na+
B.Na+およびCa2+
C.Ca2+
D., K+
骨格筋細胞におけるエンドプレート電位は、原則として、以下のイオンのどれに対する透過性の低下によって生成され得るか? (以下に列挙する各イオンに対する有限の初期透過性が存在し、生理学的濃度勾配が存在すると仮定する。A.Na+この答えは間違っています。
エンドプレートポテンシャルは、通常、ナトリウムおよびカリウムイオンに対する透過性の同時増加によって生成される脱分極である。, ナトリウム透過性の選択的減少があった場合、そのような減少は脱分極につながらない。 むしろ、GHK方程式のアルファが減少するため、実際には過分極につながるでしょう。 ナトリウムおよびカリウムに対する透過性の比はカリウム透過性に向かって好まれ,膜電位をカリウム平衡電位に向かって移動させ,過分極を生じる。
B.Na+およびCa2+
C.Ca2+
D., K+
骨格筋細胞におけるエンドプレート電位は、原則として、以下のイオンのどれに対する透過性の低下によって生成され得るか? (以下に列挙する各イオンに対する有限の初期透過性が存在し、生理学的濃度勾配が存在すると仮定する。A.Na+
B.Na+とCa2+この答えは間違っています。
ナトリウムおよびカルシウムに対する透過性が低下した場合、その結果は選択Aと同様である。, 同様に、カルシウムへの透過性を低下させることはまた、細胞を過分極させる可能性がある。 カルシウム平衡電位は非常に正の値であり、カルシウムに対する強壮安静透過性があれば、その透過性は膜電位の強壮脱分極に寄与するであろう。 したがって、カルシウム透過性の低下は、その強壮性脱分極効果を除去し、過分極をもたらすであろう。
C.Ca2+
D., K+
骨格筋細胞におけるエンドプレート電位は、原則として、以下のイオンのどれに対する透過性の低下によって生成され得るか? (以下に列挙する各イオンに対する有限の初期透過性が存在し、生理学的濃度勾配が存在すると仮定する。A.Na+
B.Na+およびCa2+
C.Ca2+この答えは間違っています。
カルシウム透過性の低下だけでは、もしあれば過分極を引き起こすでしょう。 選択Bに対する応答の論理を参照してください。
D。, K+
骨格筋細胞におけるエンドプレート電位は、原則として、以下のイオンのどれに対する透過性の低下によって生成され得るか? (以下に列挙する各イオンに対する有限の初期透過性が存在し、生理学的濃度勾配が存在すると仮定する。):
A.Na+
B.Na+とCa2+
C.Ca2+
D.K+この答えは正しいです!
カリウム透過性の低下は、エンドプレートポテンシャルと同様の脱分極につながる。, これは、安静時にカリウムとナトリウムに対する強壮透過性があるためです。 カリウムに対する高透過性は,膜電位をカリウム平衡電位近くに保つ傾向があった。 その休止透過性が低下すると、ゴールドマン方程式のαはより大きな値になり、膜電位をナトリウム平衡ポテンシャルに少し近づける(すなわち脱分極)。