はじめに
リパーゼは、脂肪酸のエステルを加水分解することによって脂質の分解を触媒する。 その機能は、消化および腸内の脂肪の吸収を促進するために重要である。 リパーゼは主に膵臓に見られ、膵臓によって分泌されますが、唾液および胃にも見られます。
- 右に描かれている膵リパーゼ(PDB ID:1hpl)は、カルボン酸エステル加水分解酵素である。 それはまた一般に膵臓のtriacylglycerolのリパーゼと呼ばれ、酵素のクラス数はE.C.3.1.1.3です。,
- 胆汁塩刺激リパーゼ(BSSL)は母乳中に見出される。
- ホルモン感受性リパーゼ(LIPE)は、様々なエステルを加水分解する。 詳しくはホルモン感受性リパーゼを参照のこと。
- モノアシルグリセロールリパーゼ(MAGL)は細胞内トリグリセリドを脂肪酸とグリセロールに加水分解する。 MAGLはLIPEとともに機能します。 詳細はモノグリセリドリパーゼを参照。
この酵素によって触媒される反応を以下に示す。
さらなる分解は、最終的に2-モノアシルグリセロールおよび遊離脂肪酸をもたらす。, メカニズムの詳細な議論は、リパーゼ触媒機構のセクションで見つけることができます。 リパーゼの構造と機能の決定は段階的なプロセスであった。 リパーゼ活性は1846年にクロード-ベルナールによって膵臓で最初に実証された。 但し、それはMattsonおよびBeckがトリグリセリドの第一次エステルのための膵臓のリパーゼの高特異性を示した1955年までなかった。 近年、膵リパーゼの結晶構造の決定は、多くの科学者がこれを促進するために働いてきたので、主な焦点となっている。,
も参照してください
- 分子遊び場/膵臓リパーゼ
- リパーゼ蓋モーフ
- ホルモン感受性リパーゼ
- 閉じた状態のカンジダ南極からのリパーゼ
- モノグリセリドリパーゼ
- ヒト胃リパーゼ
- リパーゼ(ヘブライ語)
- ヒト胃リパーゼ
- リパーゼ(ヘブライ語)
- ヒト胃リパーゼ
- リパーゼ(ヘブライ語)
- 脂質代謝
構造
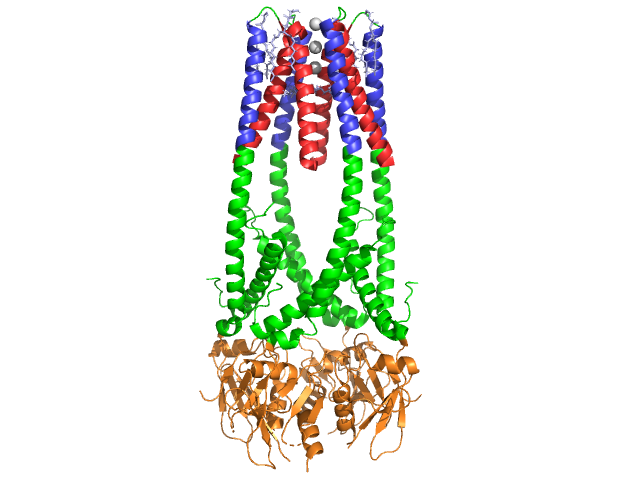
膵臓リパーゼは50kdaタンパク質である。, 結晶学的非対称ユニットには二つの同一の鎖が含まれていますが、データファイル350の情報(REMARK1hpl)は、二量体が結晶化アーチファクトであり、機能形態(生物学的集合体とも呼ばれる)が単一鎖(モノマー)であることを示しています。 鎖は449残基からなる。 リパーゼのsは(一つのサブユニットで)102残基が含まれており、赤で示されている13のαヘリックスを作成し、139残基が金で示されている28鎖を合計βシートに関与している。 アルファらせんはタンパク質の22%を占め、ベータシートは30%を占める。, 各チェーンは、二つの明確に定義されてい 青色で示されているN末端ドメインは、α/βヒドロラーゼフォールドによって特徴付けられる。 緑色で示されているC末端ドメインは、コリパーゼと相互作用するベータシートサンドイッチを含んでいるが。 リパーゼの各単量体および二量体構造は、ジスルフィド結合、水素結合、および静電相互作用(塩橋)によって一緒に保持される。 リパーゼはシステイン残基の間に12個の合計を有する。 ArgおよびLysの正電荷窒素(青)、およびAspおよびGluの残余の否定的な酸素(赤)の間で形作られます。, (黄色で)また主鎖と側鎖原子間の酵素を安定させます。 リパーゼは残基の明確な分布を有する(紫色のスペースフィルは極性残基を表す)。 疎水性崩壊は、(白で示されている)タンパク質の内部を構成し、極性残基(透明な青色)が表面にあるため、二次構造および三次構造の多くに寄与する。 さらに、リパーゼは二つを有する。 一つは各単量体サブユニットに埋もれている。 カルシウムイオンは蛋白質の折り畳みおよび酵素活性に必要です。, 画像は、Glu187、Arg190、Asp192、およびAsp195残基によって配位されたサブユニットA中の緑色のカルシウムイオンを示しています。 Ca(+2)電荷は、負に帯電したグルタミン酸およびアスパラギン酸残基、および二つの水分子(ピンク)からの酸素原子によって安定化される。
さらに、リパーゼは、溶媒が活性部位に入るのを阻止する独特の(緑色)を有する(赤色)。 ふたはoxyanionの穴を保護する25残余の螺旋形の構造である。, リパーゼ結合部位の二次構造をa(赤の活性部位)からa(青の活性部位、宇宙フィルのトリアシルグリセリド)に変化させる劇的なシフトを受けるため、lid(黄色)は基質結合にとって特に重要である(この遷移のアニメーションについてはLipase lid morphを参照)。 蓋の開口部は、主にβ延長された確認から、活性部位の半分以上がアルファらせんから形成される構造への二次構造の変化を伴う。,
コリパーゼ補酵素
リパーゼは、リパーゼのc末端の非触媒ドメインに結合する補酵素であるコリパーゼによって活性化される。 コリパーゼは、不活性な形態で膵臓によって分泌される10kDaタンパク質である。 それは2つの保存された(黄色で示されている)、親水性表面(リパーゼC末端相互作用の部位-青で示されている)と疎水性表面(脂質を橋渡しするための複数の疎水性ループを含んでいる-白で示されている)を有する。 トリプシンは補因子がリパーゼと相互に作用することができる前にそれからcolipaseを活動化させます。,
コリパーゼはリパーゼの活性化のために存在しなければならず、リパーゼと脂質の間の橋渡しとして作用する。 コリパーゼが結合すると、活性リパーゼはトリアシルグリセリドとの疎水性相互作用に対して安定化される。 コリパーゼが存在しないと,十二指腸の油/水界面に両親媒性物質が蓄積することにより,すいリパーゼがその基質に結合することが妨げられることが分かった。 . コリパーゼおよびリパーゼは、C末端上の活性部位の反対側にある(接触はピンクおよび黄色の領域であり、水分子はより暗い青色で示されている)。 酵素は、およびのような極性相互作用によって結合される。,
コリパーゼの存在下で、酵素が活性化され、アミノ酸216-239で構成される(赤色で示され、緑色で活性部位に示される)を移動させる。 N末端フラップは、c末端ドメインと共に協調的に移動して活性部位(緑色)を明らかにし、基質と結合することを可能にする。 この柔軟性は,コリパーゼ-リパーゼ複合体を水-脂質界面と結合させる上で重要であると仮定した。 フラップの再編成はまた、オキシアニオンホールを作成する第二の立体配座変化を誘発する。,
リパーゼ触媒機構
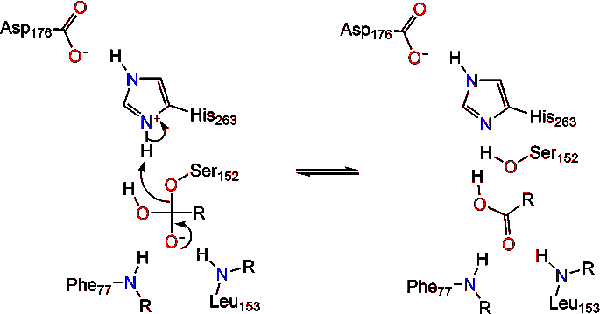
トリアシルグリセリドの脂質-水界面でのリパーゼ活性化は、コリパーゼおよび胆汁塩の存在下で、界面活性化として知られている。 ヒドロロイシス反応が起こるために、コリパーゼはリパーゼをミセルの脂質-水膜に固定し、リパーゼの表面変化を引き起こす。 コリパーゼの四つの疎水性ループはトリアシルグリセリドの疎水性atmosphere atmosphereと相互作用する。 これは、脂質への活性部位結合を開始し、トリアシルグリセロールのためのより疎水性環境を明らかにするために蓋開きを開始する。, これはそれから、triacylglycerolが触媒作用のトライアドのような主活性部位の残余と相互に作用するようにします。 リパーゼの酵素の多様な配列は実際のところ見つけることができます。 異なる形態は多様なタンパク質足場を占めるが、ほとんどはα/βヒドロラーゼフォールド上に構築され、酸性残基、ヒスチジン、およびセリン求核剤からなるキモトリプシン様を有する。 ウマ膵リパーゼの場合、触媒トライアドはで構成される。 この触媒起機能なども見つかります。, まず、アスパラギン酸はHis263と水素結合を形成し、ヒスチジンイミダゾール窒素のpKaを増加させる。 これにより、ヒスチジンは強力な一般的な塩基として作用し、セリンを脱プロトン化することができる。 脱プロトン化されたセリンは求核剤として機能し、脂質基質のグリセロール骨格の1または3炭素上の脂肪酸のいずれかのエステルカルボニルを攻撃することができる。 脂質を攻撃すると、負に帯電した四面体中間体が形成される(反応1)。 これは、二つの残基によってオキシアニオン孔内で安定化される:。,
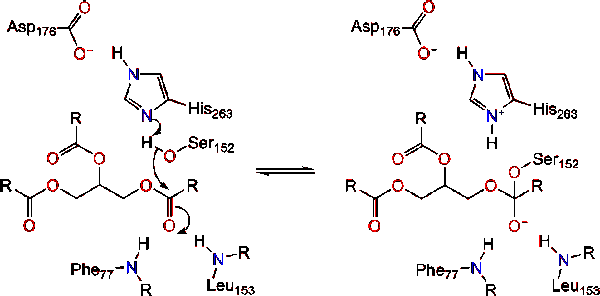
カルボニルは脱離基として作用するグリセロール骨格セグメントを有する改革を行う(反応2)。
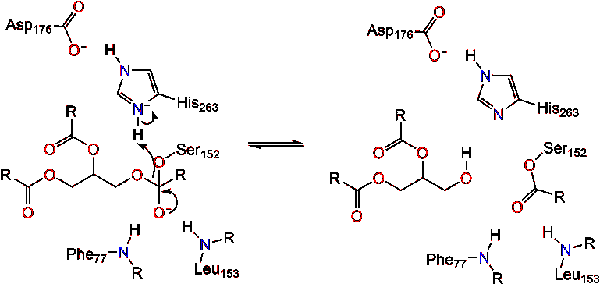
水分子はヒスチジンにプロトンを与え、反応性ヒドロキシルアニオンを生成する。 ヒドロキシルアニオンは脂質のカルボニル炭素を攻撃し、オキシアニオンホールで安定化された別の負に帯電した四面体中間体を形成する(反応3)。,
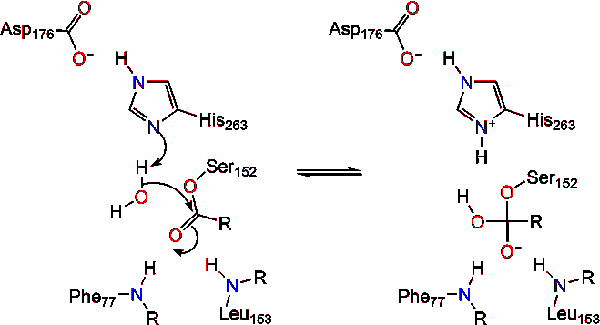
カルボニルの改革により、触媒セリンが放出され、モノグリセリドと脂肪酸モノマーが拡散する(反応4)。
膵臓のリパーゼの阻止
(紫色)、C11アルキルホスホネートは、膵臓のリパーゼの競争の抑制剤です。 それは活性部位のポケットに直接結合する。 また、リパーゼと関連する五つのB-オクチルグルコシド(灰色および赤色)分子も存在する。, MUPは、触媒トライアドの一部であるSer152およびHis263、およびオキシアニオン孔に位置する安定化残基であるPhe77およびLeu153と水素結合を形成する。MUPは、疎水性側鎖Ala178、Phe215、Pro l80、Tyr ll4、Leu213とファンデルワールスが接触することによって示された(青色で示されている)。
タンパク質-基質相互作用
リパーゼは、多数の疎水性contactsと結合する。 ここで見られるように、リパーゼはタンパク質内の疎水性裂け目を介してコレステリルリノール酸のアルキル基と相互作用する。, この裂け目は脂肪分解の反作用を最大限に活用するために分子を方向づけます。
このシーンで示されているのは、酵母Candida rugosaからのリパーゼであり、コレステリルリノール酸(灰色)の二つの分子を有する。 Ser152、Asp176、およびHis263を含む活性部位残基は、赤い棒の表現で示されている。 リパーゼは、二つの同一のサブユニットが同一の反応を触媒するという事実のために、二つの脂質分子を収容することができる。 一つのリパーゼ分子は一度に二つの脂肪分解反応を触媒することができる。,
臨床的意義
膵臓リパーゼは、膵臓の管系を介して十二指腸に分泌される。 健康な個体では、それは血清中の非常に低い濃度である。 膵臓機能の極度な中断の下で、膵臓炎または膵臓癌のような、膵臓はそれ自身を消化し、血清に膵臓のリパーゼを含む膵臓の酵素を解放し始めるかもし 従って膵臓のリパーゼの血清の集中の測定は激しい膵臓炎の診断を援助できます。., 脂肪の消化力そして吸収のリパーゼの活動が原因で、ずっと減量の医薬品のリパーゼの抑制剤のための成長市場があります。 最も人気のあるものは、Streptomyces toxytriciniからの天然産物であり、不可逆的なリパーゼ阻害剤であるlipostationの水素化生成物であるOrlistat(またはXenical®)である。 この抑制剤はまた事実上irreversible逆であるほど遅い加水分解するエステルを作り出すSer152の不良部分によって機能します。
リパーゼの3D構造
リパーゼの3D構造