イオンとは何ですか?
イオンは電荷を運ぶ原子または分子です。
イオンは、電荷の符号と大きさを示すために上付き文字を使用することによって識別される。
陰イオンと陽イオン
負に帯電したイオンは陰イオンと呼ばれ、正に帯電したイオンは陽イオンと呼ばれます。,n原子はN3になるために三つの電子を得る-
陽イオンの例
- ナトリウム原子はNa+になるために電子を失う
- マグネシウム原子はMg2+になるために二つの電子を失う
- 鉄原子は三つの電子を失うfe3+になるために
- 水はh+と反応して分子カチオンh3o+
イオン形成
そうするとイオンが形成され、化学反応に関与する化学種の全ポテンシャルエネルギー,しばしば、これは達成可能な原子の異なる要素を満殻電子の
塩フッ化リチウムを考えてみましょう:
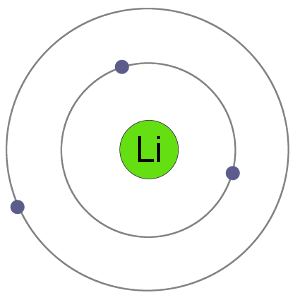
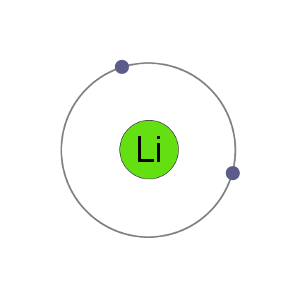
リチウム原子は3つの電子を持っています、それらは二つの殻に電子を持っていることを意味します:最初の殻に2second.By 電子を失って陽イオンになると、リチウムは希ガスヘリウムと同じ安定した電子配置を得る。,
Liアトム
Li+カチオン
フッ素原子は9つの電子を持ち、最初の殻に2つ、7つの電子を持つことを意味する。second.By 電子を得てアニオンになるフッ化物イオンは、希ガスネオンと同じ安定した電子配置を得る。,”e9c2d99c83″>
そして、イオン性化合物を形成するためのナトリウムと塩素との酸化還元反応はエネルギー的に好ましい:
塩素の還元:cl2+2e-→2cl-
全体的な反応:2na+cl2→2nacl
イオンサイズ
カチオンは元の原子よりも小さい-ナトリウム原子が三つの殻に電子を持ち、ナトリウムイオンは二つの殻に電子を持っている方法を考えてみましょう。,より多くの電子では、アニオンは元の原子よりも大きい。
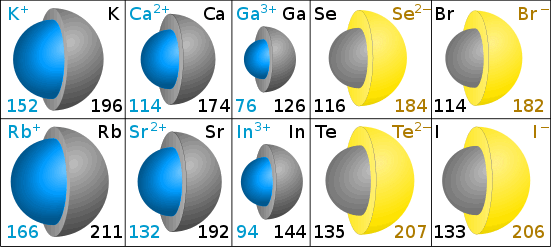
イオンサイズは、イオン半径によって測定される。
ピコメーターでのイオン半径
図の灰色は、元の原子のサイズを示しています。 青色(陽イオン)と黄色(陰イオン)はイオンの大きさを示しています。 (クリス-キングによる図。)

イオン性化合物
塩化ナトリウム(NaCl)などのイオン性化合物は、アニオンとカチオンの間の静電引力のために形成される。,イオン性化合物は、正電荷の総数と負電荷の総数が常に等しいため、電気的に中性である。
化学元素を考慮すると、イオン性化合物を形成する最も高い傾向は、最も電気陰性の金属および最も電気陰性の非金属に存在する。
電気導体
イオンは電流を運ぶことができ、これは電気化学セル、および例えば血漿中で観察することができる。
一般に、固体イオン化合物は、イオンが結晶格子内の固定位置にロックされているため、電流を運ばない。,イオン性化合物は、溶融時または溶液中に溶解したときにのみ電気を伝導し、イオンが結晶格子から放出されて可動性になる。