水分子のルイス構造は、酸素原子の周りに二つの単結合を含んでいます。 ルイス構造を描くために酸素と水素原子の全原子価電子数を用いた。 各ステップの描画ルイス構造のH2Oについて説明がこのチュートリアルです。
H2Oルイス構造
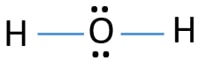
H2Oのルイス構造には、酸素原子の周りに二つの単結合があります。 水素原子は、単結合を介して酸素原子に結合している。 また、酸素原子上には二つの孤立電子対が存在する。,
水分子は単純な分子です。 水分子のルイス構造を描くことは、他の複雑な分子またはイオンのいくつかよりも簡単です。 チオ硫酸イオンのルイス構造を描くと想像してみてください。
H2Oのルイス構造を描くステップ
ルイス構造を正しく描くためには、いくつかのステップがあります。 このチュートリアルでは、H2O分子のルイス構造とそれらのステップについて詳細に説明します。 水分子は単純であるため、これらの手順のいくつかはあまり使用されていません。 このような場合には、それぞれの工程で言及される。,
- 水素原子と酸素原子の原子価殻の電子の総数を求める
- 全電子対を孤立対と結合として
- 中心原子選択
- 原子上の孤立対をマーク
- 原子
- 孤立電子対を結合に変換して、最良のルイス構造を得ることにより、安定性をチェックし、原子の電荷を最小限に抑えます。
重要:正しいルイス構造を描くことは、共鳴構造を正しく描くために重要です。,
H2Oの原子価殻の電子の総数
水素と酸素の二つの要素があります。 水素はIA族元素であり、その最後の殻(価電子殻)に唯一の電子を持っています。 酸素は、周期表の元素を介したグループであり、その最後のシェルに六つの電子が含まれています。 今、私たちは、各原子の原子価殻に含まれている電子の数を知っています。,
- 水素原子によって与えられる価電子数=1*2=2
- 酸素原子によって与えられる価電子数=6*1=6
- 全価電子数=2+6=8
全価電子数対
全価電子数対=価電子殻におけるπ結合+π結合+孤立電子数
全電子対は、全原子価電子数を二つで割ることによって決定される。 のために、H2O、電子の総対は、それらの価電子殻において4である。,
H2Oの中心原子
中心原子となるためには、より大きな価数を有する能力が重要である。 次に、水素と酸素から、どの原子が最も高い原子価を持っていますか? 酸素の最大原子価は二つである。 水素の唯一の原子価は一つです。 したがって、酸素原子はH2Oの中心原子でなければなりません。H2Oのスケッチを描いて、原子が分子内にどのように配置されているかを示すことができます。
原子上の孤立電子対
中心原子とH2O分子のスケッチを決定した後、原子上の孤立電子対をマークする必要があります。, 四つの電子対の合計があることを覚えておいてください。
- 描かれたスケッチ構造にはすでに二つのH-O結合があります。 今だけ二つの(4-2)電子対が原子上にマークするために残っています。
- 通常、残りの電子対は外側の原子にマークするように開始する必要があります。 しかし、H2Oでは、水素原子は、その最後のシェルに二つ以上の電子を保持することはできません外側の原子です。 そのため、できませんのでマークの二つの電子がペアを水素原子です。,酸素

原子の電荷をマークします
酸素原子と水素原子に電荷はありません。
孤立電子対を結合に変換することにより、安定性をチェックし、原子の電荷を最小限に抑えます
原子に電荷がないため、最良のルイス構造を描くステップとして電荷を減らす必要はありません。 すでに、H2Oのための最良のルイス構造を得ました。
質問
水に似たルイス構造は何のために描くことができますか?,
水分子のルイス構造には、スルフラトムの周りに二つのシグマ結合と二つの孤立対があります。 硫化水素、二フッ化酸素(F2O)は、水と同様のルイス構造を有する。
あなたの化学の質問をして、答えを見つける
関連するチュートリアル