HLA-B27関連急性前部ブドウ膜炎(AAU)は、内因性ブドウ膜炎の最も頻繁なタイプであり(下の画像を参照)、西洋諸国のすべての前部ブドウ膜炎症例の18-32%、アジアのすべての前部ブドウ膜炎症例の6-13%を占めている。 アジアの比較的低い頻度はこの集団で見つけられるHLA-B27のより低い頻度と関連しています。, 前述のように、HLA-B27多型および非MHC遺伝子などの異なる遺伝的要因に起因する可能性のあるhla-B27関連AAUの様々なグローバルパターンが存在する。 これらの地理的変動は、まだ未確認の病原性環境要因のためにも存在する可能性がある。
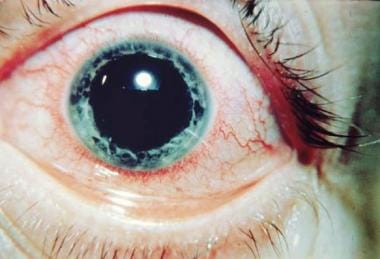 強直性脊椎炎における急性前部ブドウ膜炎。 ポール*ディエップ、BSc、MD、FRCP、FFPHMの礼儀。,
強直性脊椎炎における急性前部ブドウ膜炎。 ポール*ディエップ、BSc、MD、FRCP、FFPHMの礼儀。, 研究は、HLA-B27関連ブドウ膜炎は、強直性脊椎炎、反応性関節炎、乾癬性関節炎、および炎症性腸疾患などの血清陰性関節炎症候群と男性優位性および頻繁に関連することを特徴とする別個の実体であることを示している。 HLA-B27関連AAUの最初のエピソードは、20-40歳の患者に最も一般的に発生しますが、HLA-B27陰性AAUの発症年齢は十年後に発生する傾向があります。 AAU患者のうち、50-60%がHLA-B27陽性であり得る。, それは一般に苦痛、赤みおよびphotophobiaの古典的なトライアドとして示す温和なnongranulomatous一方的な病気です。
角膜症状には、細かい角質沈殿物および内皮上のフィブリンが含まれ得る。 角膜浮腫は、内皮の妥協および代償不全に起因する可能性がある。 慢性ぶどう膜炎では角膜上皮にカルシウムが蓄積する帯角症が見られることがある。, 前房は細隙灯検査で見られるヘイズである細胞およびフレアを示し、血液水関門の崩壊による前房内のタンパク質蓄積を反映し、重度の炎症では前房内の線維性浸出液が瞳孔を閉塞し、以下に示すように虹彩ボンベを引き起こす可能性がある。 このフィブリンは、内因性眼内炎、白内障、またはhypopyonと間違えられることがあります。 Hypopyonが見られることがあり、まれに、重度の拡張された虹彩血管の結果として自発的なhyphemaさえも起こる。,
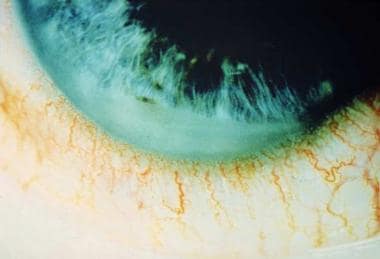 強直性脊椎炎における前房フィブリンコレクション。 ポール*ディエップ、BSc、MD、FRCP、FFPHMの礼儀。
強直性脊椎炎における前房フィブリンコレクション。 ポール*ディエップ、BSc、MD、FRCP、FFPHMの礼儀。 色素分散体、瞳孔縮瞳、および虹彩結節が認められることがあり、前方および後方の両方の結節形成が起こり得る。 後部セグメントの関与は比較的まれであるが,嚢胞様黄斑浮腫,disc板浮腫,平底ex出液,または脈絡膜炎等がみられることがある。 眼内圧はしばしば低く、毛様体の炎症および小柱メッシュワークを伴う水性産生の減少に続発する。, 炎症性細胞および破片が小柱網を詰まらせる場合、特に流出の既存の貧弱な施設を有する患者において、眼内圧も高くなることがある。
AAUは一般的に、3ヶ月まで数日から数週間の短いコースを実行し、特にHLA-B27陽性の個人では、同じ目で再発する傾向があります。 AAUの合併症としては,白内障,緑内障,低血圧,嚢胞様黄斑浮腫,および結膜形成が挙げられる。, 全身性疾患の有無にかかわらず、HLA-B27に関連する前部ブドウ膜炎の予後は、特発性前部ブドウ膜炎を伴うHLA-B27陰性の患者と比較して、あまり好まし 後遺症の可能性にもかかわらず、全体的な予後は良好である。
古典的なAAUは、速やかかつ積極的に扱われたときに完全に解決されます。 治療されていないまたは誤診された症例は、血液-水性関門の永久的な損傷のために慢性虹彩毛様体炎に進行することがある。,
診断
注意深い病歴および身体検査は、通常、全身疾患およびHLA-B27に関連するぶどう膜様実体をHLA-B27に関連しないものと区別するのに役立つ。 AAUを引き起こす疾患は様々であり,外傷性虹彩炎,皮疹後摘出虹彩炎,若年性関節リウマチ,ヘルペス感染(単純ヘルペスおよび帯状疱疹の両方),梅毒,サルコイドーシス,フックスヘテロクロミック虹彩毛様体炎,緑内障嚢胞性発症,ベーチェット病および低悪性度眼内炎が含まれる。,
片側性AAU患者におけるHLA-B27検査の役割は、鑑別診断において重要である。 一方的なAAUのHLA-B27抗原の欠乏は他の特定のぶどう膜炎の実体および他の全身の病気を捜す臨床医のための糸口であるかもしれません。 それはまたhla-B27と関連付けられるaauがhla-B27陰性の患者のそれと比較されたとき、全身の病気の不在下で、より少なく好ましく、再発するために本当らしいので、AAUの予想の決定に有用であるかもしれません。,
治療
AAUの医学的管理には、局所または全身性コルチコステロイドおよび局所環状麻痺が含まれる。 眼周囲の副腎皮質ホルモンの注入は特に後部の区分の介入が起こるとき、激しく、反抗的な、またはnoncompliant場合に非常に有用です。 免疫抑制療法は難治性のケースまたは副腎皮質ホルモン誘発有害作用のそれらの患者で必要かもしれません。 主な目標は、すべての細胞を排除することであり、それによって白内障、嚢胞様黄斑浮腫、低血圧、結膜形成、または緑内障を含む合併症を最小限に抑える,
Cycloplegicsは、毛様体痙攣に続発する光恐怖症を和らげ、結節形成を予防および破壊するのに役立ちます。 ほとんどの場合、1%シクロペントラート塩酸塩または1%トロピカミドなどの短時間作用性滴で十分である。 これらは中断されたとき瞳孔運動および急速な回復を可能にします。 5%のhomatropine、0.25%のscopolamineおよび1%のatropineのような長時間作用性のcycloplegicsは、また有用かもしれません。 ぶどう膜炎がより重度である場合、循環麻痺のより頻繁な投与が必要な場合がある。,
局所コルチコステロイドはブドウ膜炎治療の主力であるが、それらの副作用のために慎重に使用されるべきである。 目標は、炎症を制御し、合併症を予防するために必要な最小限の量を使用することです。 積極的な初期治療は回復を早め、治療期間を制限することがある。 あらゆる時間を与えられるPrednisoloneのアセテート1%は激しい提示のために強く推薦 通常、最大頻度で2-3週間は、すべての細胞を完全に排除するために必要なすべてである。 常に用量を先細りによってコルチコステロイドを中止します。,
コルチコステロイドは、局所、眼周囲、眼内(硝子体内)、および全身を含む4つの経路によって投与することができる。 局所療法は、前方ブドウ膜炎で使用されます。 投薬は毎時から一度毎日に変わります。 軟膏の形態は低下の防腐剤を容認できないし、長時間作用型の就寝時の適量のために特に有用かもしれない人に利用できます。 時には、重度の炎症が反応しないことがあり、特に後部区分が関与する場合には、眼周囲、眼内、または全身性コルチコステロイドを必要とすることが, Periocular副腎皮質ホルモンは通常副ほぞスペースのターミナルの注入として与えられます。注射または持続放出デバイスの移植による硝子体内コルチコステロイドは、慢性ぶどう膜炎およびぶどう膜炎性嚢胞様黄斑浮腫の両方の治療に有用であることが示されている。 これらの持続的な装置は、移植後数年間も薬物を放出することができるので、長期にわたる炎症の治療において特に有望である。, これにより、全身性コルチコステロイドまたは免疫抑制剤の減少または排除が可能になり、それによりこれらの薬剤による治療に関連する有害作用 あらゆる副腎皮質ホルモンの処置と同じように、intraocular圧力は定期的に監視されるべきです。全身性コルチコステロイドは、経口または静脈内投与することができる。 これらは、全身性疾患が同様に治療を必要とする場合に特に有益である。 患者と副腎皮質ホルモンの悪影響を論議し、患者の第一次心配の医者によって監視されるこれらを持っていることは重要です。, 1mg/kg/dのプレドニゾンは有用な開始用量である。
日常生活の活動を妨げる視覚を脅かす炎症、コルチコステロイド治療に対する応答の欠如、およびコルチコステロイドの不耐性を有する患者において、より強力な免疫抑制が必要とされる可能性がある。 彼らの徴候を制御するために10mgまたは多くを取っている患者はより安全な長期処置として代謝antim抗剤から寄与するかもしれません。 このような状況で使用される薬物には、アザチオプリン、ミコフェノール酸モフェチル、シクロホスファミド、クロランブシル、メトトレキサート、タクロリムス、およびシクロスポリンが含まれる。, これらのエージェントは後部のぶどう膜炎かpanuveitisで普通使用されますが、時折反応関節炎か強直のspondylitisと関連付けられる厳しいfibrinous前方のぶどう膜炎で必
シクロスポリンは、全身性コルチコステロイドの補助剤としてますます有用になってきています。 それは寛解が達成されれば医者が副腎皮質ホルモンを減らすか、または全く撤回するようにするかもしれません。 通常の用量は2.5-5mg/kg/dであり、血圧および腎機能の注意深いモニタリングが必要である。, 治験療法には、シクロスポリンまたは脂溶性の高いステロイドフルオシノロンおよびCD4分子に対するモノクローナル抗体を含む徐放性デバイスが含まれる。
ブドウ膜炎に対する現在の治療法は、その作用機序において非特異的なままであり、既に述べたように、多くの有害作用を有する。 これにより、免疫調節を扱ういくつかの治療法が検討されている。 二つの有望な治療法は、抗腫瘍壊死因子α(抗TNF-α)とHLA-B27経口寛容療法の使用を含みます。, TNF-αは、動物実験およびヒト実験研究の両方において、AAUを含む様々な形態のぶどう膜炎の病因において重要な炎症性の扇動因子であることが示され これを考慮して、種々の形態のぶどう膜炎の治療における抗TNF-αの有効性および安全性を検討するための調査が行われ、良好な結果が得られた。 インフリキシマブは、ヒトTNF-αに対するマウス-ヒトキメラモノクローナル抗体である。, ベーチェット病および難治性後部ブドウ膜炎における視力を脅かす眼の炎症の迅速で効果的で安全な治療法であることが示されている。
エタネルセプトは、TNF-αおよびTNF-βの両方に結合して不活性化する遺伝子組み換え融合タンパク質である。, ある研究では、若年性リウマチ性ブドウ膜炎および特発性ブドウ膜炎の小児における慢性前ブドウ膜炎を含む耐性慢性ブドウ膜炎の治療において、少なくとも3ヶ月間皮下に注射すると、眼の炎症および関節の炎症の両方を改善するこのタンパク質の有効性が示された。 これは全身の副腎皮質ホルモンおよび/または全身のmethotrexate両方の減少を可能にしました。
経口寛容は、特異的な末梢免疫寛容を誘導するために抗原を経口的に投与することを含む。, 経口寛容のメカニズムは不明であるが、特定の抗原および抗原用量に依存する活性抑制またはクローンアネルギーの生成を伴うと考えられている。 経口耐性は、多発性硬化症、関節炎、糖尿病、重症筋無力症、およびブドウ膜炎を扱う実験モデルにおいて成功することが示されている。, これに基づいて、臨床調査は慢性関節リウマチの多発性硬化症のミエリン、コラーゲン、および中間および後部のぶどう膜炎のぶどう膜形成のペプチッドのような抗原を使用して、再度成功および処置からの少数の悪影響を用いて始められました。 網膜自己抗原を模倣するHLA-B27由来ペプチド(B27PD)は、動物モデルおよびブドウ膜炎患者の両方に有効であることが見出されている。
その他の新たな治療選択肢には、hla-B27関連AAUの誘発に対するグラム陰性細菌感染の関与する役割を考慮した抗生物質療法が含まれる。, Sulfasalazineの処置はAAUの再発攻撃の数の減少に於いての潜在的な役割のために調査され、予防するciprofloxacinはまた調査されましたが、悪影響および費用の点から見て有
将来の新しい潜在的な治療法は、免疫系のより良い理解に基づいて、サイトカイン、ケモカイン、細胞接着分子、およびT細胞サブセットなどの物質,
AAUの管理におけるリウマチ専門医の役割は、存在し得る根底にある全身性疾患を特定し、その後の免疫抑制療法を監視する上で重要である。