Introduzione
La lipasi catalizza la degradazione dei lipidi idrolizzando gli esteri degli acidi grassi. La sua funzione è importante per la digestione e promuovere l’assorbimento dei grassi nell’intestino. La lipasi si trova principalmente e secreta dal pancreas, ma si trova anche nella saliva e nello stomaco.
- Lipasi pancreatica (PDB ID: 1hpl) che è raffigurato a destra, è un idrolasi estere carbossilico. È anche comunemente chiamato triacilglicerolo lipasi pancreatica e il suo numero di classe enzimatica è E. C. 3.1.1.3 .,
- La lipasi stimolata dal sale biliare (BSSL) si trova nel latte materno.
- La lipasi ormone-sensibile (LIPE) idrolizza una varietà di esteri. Per i dettagli vedi lipasi sensibile all’ormone.
- La monoacilglicerolo lipasi (MAGL) idrolizza i trigliceridi intracellulari in acidi grassi e glicerolo. MAGL funziona insieme a LIPE. Per i dettagli vedere Monogliceride lipasi.
La reazione catalizzata dall’enzima è mostrata sotto.
Un’ulteriore scomposizione si traduce in 2-monoacilgliceroli e acidi grassi liberi ., Una discussione approfondita del meccanismo può essere trovata nella sezione del meccanismo catalitico della lipasi. La determinazione della struttura e della funzione della lipasi era un processo graduale. L’attività della lipasi è stata dimostrata per la prima volta nel pancreas da Claude Bernard nel 1846. Tuttavia, non è stato fino al 1955 che Mattson e Beck hanno dimostrato un’alta specificità della lipasi pancreatica per gli esteri primari dei trigliceridi . Negli ultimi anni, la determinazione della struttura cristallina della lipasi pancreatica è diventata l’obiettivo primario poiché molti scienziati hanno lavorato per promuovere questo.,
Vedi anche
- Molecolare Giochi/Lipasi Pancreatica
- Lipasi coperchio morph
- la lipasi ormono sensibile
- Lipasi da Candida antartide in stato chiuso
- Monoglyceride lipasi
- Umana, la lipasi gastrica
- Lipasi (in ebraico)
- il metabolismo dei Lipidi
Struttura
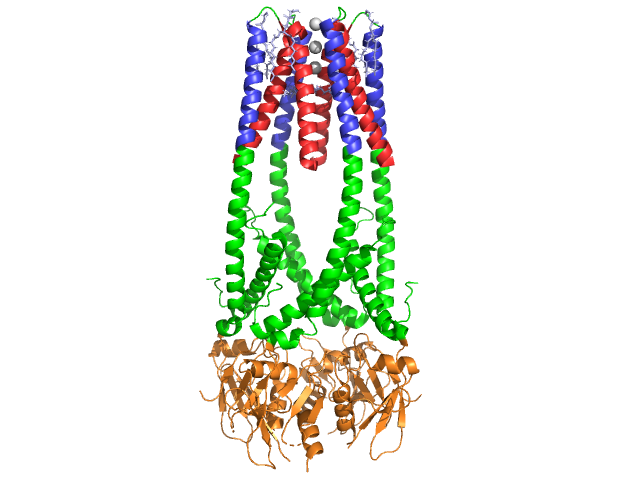
la lipasi Pancreatica è a 50 kDa., Mentre l’unità asimmetrica cristallografica contiene due catene identiche, le informazioni (NOTA 350) nel file di dati 1hpl indicano che il dimero è un artefatto di cristallizzazione e che la forma funzionale (chiamata anche assemblaggio biologico) è una singola catena (monomero). La catena è composta da 449 residui . La s di lipasi (in una subunità) comprende 102 residui che creano 13 alfa eliche, mostrato in rosso, e 139 residui coinvolti in fogli beta per un totale di 28 fili, mostrato in oro. Le alfa eliche rappresentano il 22% della proteina, mentre i fogli beta comprendono il 30%., Ogni catena contiene due ben definiti . Il dominio N terminale, mostrato in blu, è caratterizzato da una piega alfa/beta idrolasi. Mentre il dominio terminale C, mostrato in verde, contiene un sandwich di fogli beta che interagisce con colipasi . Ogni struttura monomerica e dimerica della lipasi è tenuta insieme da legami disolfuro, legami idrogeno e interazioni elettrostatiche (ponti salini). La lipasi ha 12 totali tra i residui di cisteina. si formano tra i nitrogeni a carica positiva (blu) in Arg e Lys e gli ossigeni negativi (rosso) nei residui di Asp e Glu., (in giallo) stabilizza anche l’enzima tra gli atomi della catena principale e della catena laterale. Lipasi ha una distribuzione distinta di residui (viola spacefill rappresenta residui polari). Il collasso idrofobo contribuisce a gran parte delle strutture secondarie e terziarie, poiché (mostrato in bianco) costituiscono l’interno della proteina, mentre i residui polari (blu trasparente) sono sulla superficie . Inoltre, la lipasi ne ha due . Uno è sepolto in ogni subunità monomerica. Lo calcium calcio è essenziale per il ripiegamento delle proteine e l’attività enzimatica ., L’immagine mostra lo ion di calcio verde nella subunità A, coordinato dai residui Glu187, Arg190, Asp192 e Asp195. La carica Ca(+2) è stabilizzata dai residui di glutammato e aspartato caricati negativamente e dagli atomi di ossigeno di due molecole d’acqua (rosa).
Inoltre, la lipasi ha un unico (verde) che blocca l’ingresso del solvente nel sito attivo (rosso). Il coperchio è una struttura elicoidale a 25 residui che protegge il foro di ossianione., Il coperchio (giallo) è particolarmente importante per il legame del substrato in quanto subisce uno spostamento drammatico che altera la struttura secondaria del sito di legame della lipasi da un (sito attivo in rosso) a un (sito attivo in blu, triacilgliceride in spacefill) (vedi Lipasi lid morph per un’animazione di questa transizione). L’apertura del coperchio è accompagnata da un cambiamento nella struttura secondaria da una conferma per lo più beta-estesa a una struttura in cui più della metà del sito attivo è formato da eliche alfa .,
Colipasi Coenzima
Lipasi è attivato da colipasi, un coenzima che si lega al C-terminale, dominio non catalitico della lipasi. La colipasi è una proteina 10kDa che viene secreta dal pancreas in una forma inattiva. Ha cinque conservati (mostrato in giallo) e 2 – una superficie idrofila (sito di interazione lipasi C-terminale – mostrato in blu) e una superficie idrofobica (contiene più anelli idrofobici per colmare il lipido – mostrato in bianco). La tripsina attiverà quindi la colipasi prima che il cofattore possa interagire con la lipasi.,
La colipasi deve essere presente per l’attivazione della lipasi e agisce come un ponte tra la lipasi e il lipido. Quando la colipasi si lega, la lipasi attiva è stabilizzata per l’interazione idrofobica con i triacilgliceridi . Senza la presenza di colipasi, l’accumulo di anfifile all’interfaccia olio / acqua nel duodeno impedirebbe alla lipasi pancreatica di legarsi al suo substrato. . Colipasi e lipasi sono opposte del sito attivo sul C-terminale (i contatti sono regioni di rosa e giallo, con molecole d’acqua mostrate in blu più scuro). Gli enzimi sono legati da interazioni polari come, e .,
In presenza di colipasi, viene attivato l’enzima che muove il (mostrato in rosso, sito attivo in verde) che è composto da aminoacidi 216-239. Il lembo N-terminale si muove in modo concertato insieme al dominio C-terminale per rivelare il sito attivo (verde), permettendogli di legarsi con un substrato. Si ipotizza che questa flessibilità possa avere un significato nel legare il complesso colipasi-lipasi con l’interfaccia acqua-lipide. La riorganizzazione del lembo induce anche un secondo cambiamento conformazionale che crea il foro ossianionico.,
Meccanismo catalitico della lipasi
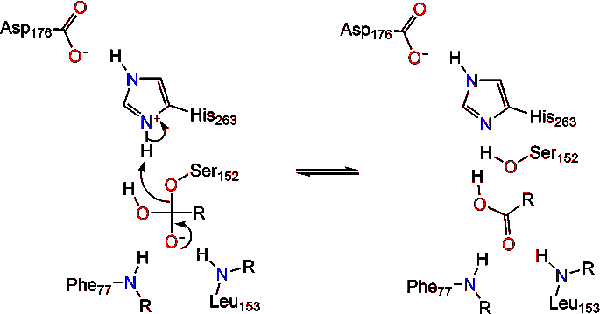
L’attivazione della lipasi all’interfaccia lipidico-acqua dei triacilgliceridi, in presenza di colipasi e sali biliari, è nota come attivazione interfacciale. Affinché la reazione di idrololisi abbia luogo, la colipasi ancora la lipasi alla membrana lipidico-acqua della micella che causa un cambiamento superficiale sulla lipasi. I quattro anelli idrofobici della colipasi interagiscono con l’atmosfera idrofobica del triacilgliceride. Questo avvia il legame del sito attivo al lipido e l’apertura del coperchio per rivelare un ambiente più idrofobo per il triacilglicerolo., Questo a sua volta, consente al triacilglicerolo di interagire con i principali residui del sito attivo come la triade catalitica. Una vasta gamma di enzimi lipasi può essere trovata in natura. Sebbene le diverse forme occupino diversi scaffold proteici, la maggior parte è costruita su una piega alfa/beta idrolasi e possiede una chimotripsina simile composta da un residuo acido, un’istidina e un nucleofilo serinico. Nel caso della lipasi pancreatica del cavallo, la triade catalitica è compresa . Questa triade catalitica funziona come la maggior parte si trovano in natura., In primo luogo, l’acido aspartico forma un legame idrogeno con il suo 263, aumentando il pKa dell’azoto imidazolico dell’istidina. Ciò consente all’istidina di agire come una potente base generale e deprotonare la serina. La serina deprotonata può quindi fungere da nucleofilo e attaccare il carbonile estere di uno degli acidi grassi sui carboni 1 o 3 della spina dorsale del glicerolo del substrato lipidico. Attaccando il lipido, si forma un intermedio tetraedrico caricato negativamente (Reazione 1). È stabilizzato nel foro di ossianione da due residui: .,
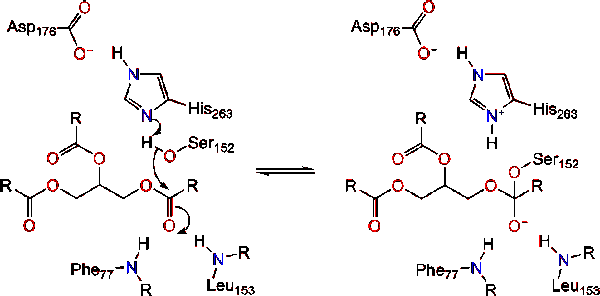
Il carbonile si riforma con il segmento dorsale del glicerolo che funge da gruppo uscente (Reazione 2).
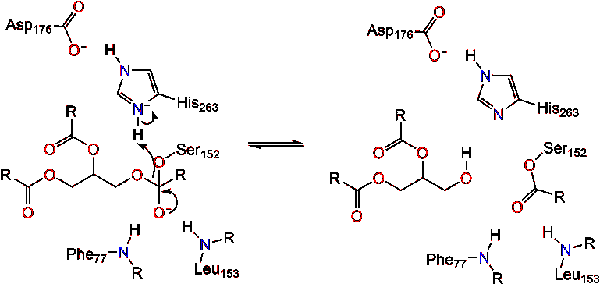
Una molecola d’acqua dona quindi un protone all’istidina, creando un anione idrossile reattivo. L’anione idrossile può quindi attaccare il carbonio carbonilico del lipido, formando un altro intermedio tetraedrico caricato negativamente che è stabilizzato nel foro dell’ossianione (Reazione 3).,
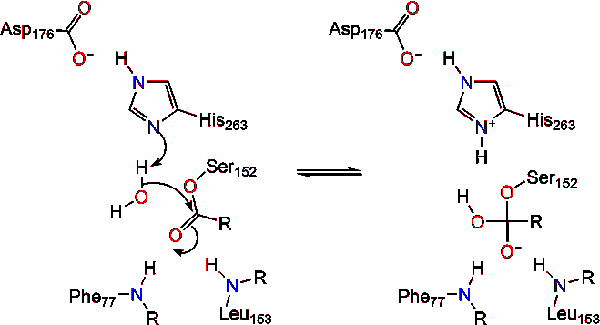
Dopo la riformazione del carbonile, la serina catalitica viene rilasciata e i monomeri di monogliceridi e acidi grassi si diffondono (Reazione 4).
Inibizione della lipasi pancreatica
(viola), un fosfonato alchilico C11, è un inibitore competitivo della lipasi pancreatica. Si lega direttamente nella tasca del sito attivo. Ci sono anche cinque molecole di B-ottilglucoside (grigio e rosso) che si associano alla lipasi., MUP forma legami idrogeno con: Ser 152 e His 263, che fanno parte della triade catalitica, e Phe 77 e Leu 153 che sono i residui stabilizzanti situati nel foro dell’ossianione .MUP è stato dimostrato di essere da contatti van der Waals con catene laterali idrofobiche Ala 178, Phe 215, Pro l80, Tyr ll4, Leu 213 (mostrato in blu).
Interazioni Proteina – substrato
La lipasi si lega con numerosi contatti idrofobici. Come si vede qui, la lipasi interagisce con il gruppo alchilico del linoleato di colesterolo attraverso una spaccatura idrofobica all’interno della proteina., Questa spaccatura orienta la molecola per ottimizzare la reazione di lipolisi.
Mostrato in questa scena è lipasi dal lievito Candida rugosa in con due molecole di colesteril linoleato (grigio). I residui attivi del sito compreso Ser152, Asp176 e His263 sono indicati nella rappresentazione rossa del bastone. La lipasi può ospitare due molecole lipidiche a causa del fatto che due subunità identiche catalizzano una reazione identica. Una molecola di lipasi può catalizzare due reazioni di lipolisi alla volta.,
Significato clinico
La lipasi pancreatica viene secreta nel duodeno attraverso il sistema di condotti del pancreas. In un individuo sano, è a concentrazione molto bassa nel siero. Sotto estrema interruzione della funzione pancreatica, come la pancreatite o il cancro del pancreas, il pancreas può iniziare a digerire se stesso e rilasciare enzimi pancreatici tra cui lipasi pancreatica nel siero. La misurazione della concentrazione sierica di lipasi pancreatica può quindi aiutare nella diagnosi di pancreatite acuta.., A causa dell’attività della lipasi nella digestione e nell’assorbimento dei grassi, c’è stato un mercato in crescita per gli inibitori della lipasi per i prodotti farmaceutici per la perdita di peso. Il più popolare è Orlistat (o Xenical®) che è un prodotto naturale da Streptomyces toxytricini ed è il prodotto di idrogenazione della lipostazione-un inibitore irreversibile della lipasi. Questo inibitore agisce anche legando Ser152, producendo un estere che idrolizza così lentamente che è praticamente irreversibile .
Strutture 3D della lipasi
Strutture 3D della lipasi